Estimée à environ 1,5 million de cas dans le monde, la cécité infantile se caractérise par une perte de vision partielle ou totale dès la naissance ou lors de la petite enfance. L’un des coupables est une mutation du gène GUCY2D, entraînant une déficience enzymatique dans le système de conversion de la lumière en signaux électrochimiques. Utilisant la thérapie génique, des chercheurs ont injecté à des patients des copies fonctionnelles du gène GUCY2D. Les résultats ont montré plusieurs améliorations de la vision et s’avèrent ainsi très prometteurs pour un futur traitement.
Selon les données initiales d’un essai clinique mené par des chercheurs du Scheie Eye Institute de la Perelman School of Medicine de l’Université de Pennsylvanie, une nouvelle thérapie génique pour l’une des formes les plus courantes de cécité congénitale est sûre et améliore la vision des patients.
La thérapie délivre des copies fonctionnelles de GUCY2D aux yeux des patients souffrant de troubles de la vision sévères causés par des mutations du gène. Chacun des trois premiers patients traités a connu une amélioration de certains aspects de la vision, sans effets secondaires graves, selon la nouvelle étude publiée dans la revue iScience. « Nous avons constaté des améliorations durables de la vision de jour et de nuit, même avec une dose relativement faible de thérapie génique », explique Samuel G. Jacobson, professeur d’ophtalmologie.
Le gène GUCY2D est l’un des quelque 25 gènes humains différents dont les mutations causent des problèmes au niveau de la rétine, entraînant une grave déficience visuelle dès la naissance ou la petite enfance. Cette famille de troubles rétiniens héréditaires, collectivement connus sous le nom d’amaurose congénitale de Leber (ACL), représente une part considérable de la cécité chez les enfants dans le monde.
La thérapie génique pour restaurer le gène GUCY2D
Les copies normales de GUCY2D codent une enzyme dans la voie clé que les cellules bâtonnet et cône sensibles à la lumière dans la rétine utilisent pour convertir la lumière en signaux électrochimiques. Un manque de cette enzyme bloque la récupération de cette voie, empêchant la réinitialisation nécessaire pour une signalisation ultérieure. En conséquence, le signal des cellules bâtonnets et cônes devient très faible — ce qui équivaut à une perte de vision sévère.
Même chez les adultes qui vivent avec cette maladie depuis des décennies, il arrive souvent que de nombreuses cellules rétiniennes sensibles à la lumière restent vivantes et intactes malgré leur dysfonctionnement. Ainsi, l’ajout de copies fonctionnelles de GUCY2D via une thérapie génique pourrait permettre à ces cellules de fonctionner à nouveau et de restaurer une certaine vision.
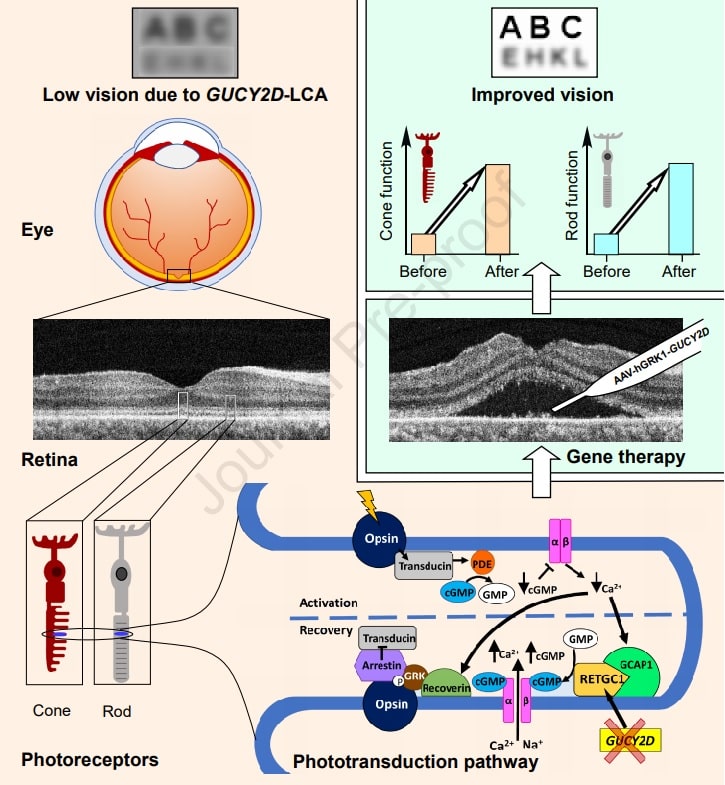
En 2019, Jacobson et Artur V.Cideciyan, professeur de recherche en ophtalmologie à la Perelman School of Medicine, ont commencé le premier essai clinique d’une thérapie génique GUCY2D : une solution contenant un virus inoffensif qui porte le gène est injectée sous la rétine — initialement dans un seul œil par patient. Les chercheurs suivent chaque patient pendant deux ans après le traitement. Dans le nouveau rapport, ils décrivent leurs résultats après neuf mois chez les trois premiers patients traités.
Des améliorations de la vision chez plusieurs patients
Le premier patient a connu une augmentation substantielle de la sensibilité à la lumière dans les cellules bâtonnets, qui sont plus sensibles à la lumière que les cellules coniques et sont principalement utiles pour la vision dans une faible luminosité, ou la « vision nocturne ». Ce patient a également montré une amélioration des réponses des pupilles à la lumière. Le deuxième patient a montré une augmentation plus faible mais soutenue de la sensibilité à la lumière dans les cellules bâtonnets, commençant environ deux mois après la thérapie génique.
Le troisième patient n’a montré aucune amélioration de la sensibilité des cellules bâtonnets, mais a montré une acuité visuelle significativement améliorée au cours de la période de suivi de neuf mois, une amélioration que les chercheurs ont liée à un meilleur fonctionnement des cellules coniques du patient, les cellules prédominantes pour la lumière du jour et la couleur.
Il n’y a eu aucun effet secondaire indésirable grave et les effets secondaires survenus dans la rétine des patients ont disparu. La dose de thérapie génique utilisée chez ces trois premiers patients était la plus faible des doses que les chercheurs prévoient d’utiliser dans l’étude, ils espèrent donc voir une sécurité continue et une plus grande efficacité chez les patients recrutés plus tard, qui recevront des doses plus élevées.


