Dans le cadre d’une ambitieuse étude visant à identifier les neurones qui se synchronisent avec le rythme cardiaque, des chercheurs australiens sont parvenus à isoler des neurones spécifiques du nerf vague essentiels à la régulation cardiovasculaire. Cette avancée, en éclairant certains mécanismes des neurones du nerf vague influençant l’activité cardiovasculaire, pourrait ouvrir de nouvelles voies thérapeutiques pour les maladies cardiaques.
Le nerf vague, également connu sous le nom de nerf pneumogastrique ou nerf crânien X, est le plus long et le plus complexe du système parasympathique. S’étendant du tronc cérébral aux organes digestifs, il joue un rôle clé dans la régulation du système nerveux autonome, du système cardiovasculaire, des fonctions digestives et dans la communication bidirectionnelle cerveau-corps.
De récentes avancées, réalisées par des chercheurs en médecine bioélectronique des Instituts Feinstein, ont permis de mettre au point une méthode innovante d’exploration des signaux neuronaux transmis par le nerf vague. Grâce à l’imagerie du ganglion jugulaire-nodulaire, abritant ces neurones, des chercheurs ont précédemment enregistré l’activité neuronale chez des modèles murins. L’utilisation d’indicateurs de calcium génétiquement codés avait révélé des réponses neuronales spécifiques à divers stimuli du nerf vague.
Jusqu’à présent, les études visant à comprendre la physiologie de ce nerf se sont majoritairement appuyées sur des modèles animaux. Le Dr David Farmer, dans un communiqué de l’Université Monash, a souligné que « les recherches animales des 150 dernières années ont fourni des informations précieuses sur le contrôle cérébral de la fonction cardiovasculaire ». Toutefois, il insiste sur l’importance d’étudier les neurones humains. En 2020, le professeur Vaughan Macefield et son équipe de l’Université Monash sont parvenus, pour la première fois, à enregistrer les signaux électriques du nerf vague chez des sujets humains éveillés.
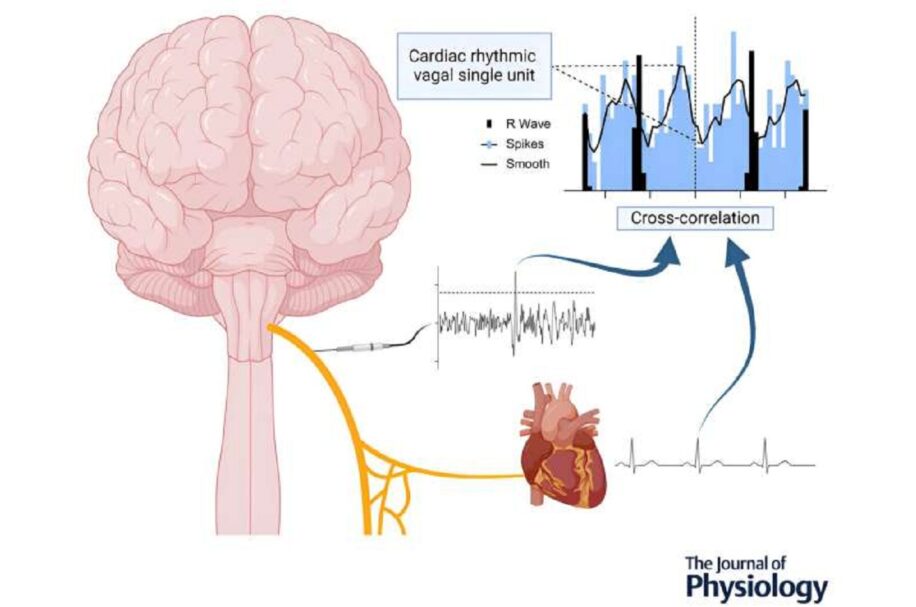
Plus récemment encore, dans le cadre d’une nouvelle recherche dont les résultats ont été publiés dans la prestigieuse revue The Journal of Physiology, les scientifiques ont étudié l’activité des axones individuels présentant une rythmicité cardiaque, enregistrée via des microélectrodes en tungstène insérées dans le cou des participants sous guidage échographique. Quinze individus, âgés de 15 à 59 ans et exempts de pathologies connues, ont participé à cette étude préliminaire.
En analysant les données de ces participants, les chercheurs du laboratoire de neurophysiologie autonome humaine de l’école de médecine translationnelle de Monash ont franchi une nouvelle étape. En se focalisant sur les signaux électriques synchronisés avec le rythme cardiaque, ils ont isolé les neurones du nerf vague cervical humain impliqués dans la régulation cardiovasculaire.
Vers une compréhension approfondie des neurones du nerf vague
Le nerf pneumogastrique fonctionne tel une autoroute bidirectionnelle entre le cerveau et les organes, par le biais des neurones qui le composent. 80 % des fibres du nerf vague sont afférentes, transmettant des informations des organes vers le cerveau, tandis que les 20 % restants sont efférentes (transmettant des signaux du cerveau vers les autres organes).
Dans son étude, le Dr Farmer a affirmé : « Nous avons réussi à isoler l’activité de neurones vagaux individuels et à identifier ceux responsables d’informer le cerveau sur la fonction cardiovasculaire (neurones afférents) ou de contrôler le rythme cardiaque (neurones efférents) ». L’équipe a isolé l’activité de 44 neurones cardiaques rythmiques, dont 22 à axones myélinisés et 22 à axones non myélinisés.
Les chercheurs ont aussi noté que l’activité des neurones vagaux ralentissant le cœur semblait réduite dans les cas de maladies cardiovasculaires. Farmer a indiqué que l’équipe n’a pas encore identifié les neurones responsables de ce phénomène. « La capacité d’isoler l’activité de ces neurones à partir d’enregistrements vagaux chez des humains pourrait nous permettre de résoudre ce problème, ce qui est plutôt captivant », a-t-il ajouté.
La prochaine étape consistera à comprendre le comportement des neurones modifiant la régulation cardiaque, cette fois en impliquant des patients atteints de maladies cardiovasculaires, contrairement aux travaux initiaux de Macefield sur des individus en bonne santé. « Comme l’activité de ces neurones est probablement altérée dans les maladies cardiovasculaires, il est crucial de comprendre comment et pourquoi cela se produit », conclut Macefield.