Les thérapies anti-âge constituent l’un des domaines majeurs de la recherche biomédicale des dernières décennies, en raison du vieillissement de la population mondiale. Étant donné son fort potentiel, elle suscite de grands espoirs. Le domaine est cependant confronté à des défis de taille, les mécanismes exacts du vieillissement demeurant jusqu’à ce jour en partie incompris. Où en sont actuellement les avancées dans le domaine et dans combien d’années pourrions-nous réellement en bénéficier ? Pour tenter de répondre à cette question, nous avons interrogé des experts de renommée internationale.
Sections principales de l’article :
-
- « Facteurs Yamanaka » : une révolution pour la médecine du vieillissement ?
- Des stratégies basées sur la reprogrammation épigénétique
- Inversion simultanée de plusieurs marqueurs du vieillissement
- Des fonctions cognitives et musculaires considérablement améliorées
- Premiers traitements disponibles dans 10 à 15 ans ?
Les dernières décennies ont enregistré un bond spectaculaire de l’espérance de vie et du nombre de seniors dans le monde, surtout dans les pays développés. L’espérance de vie moyenne en France est par exemple de 85,3 ans pour les femmes et de 79,4 ans pour les hommes, contre 69,2 et 63,4 ans respectivement dans les années 1950. D’après l’OMS, la population de plus de 60 ans pourrait doubler d’ici 2050.
Cette tendance démographique s’accompagne inévitablement d’une croissance de la prévalence des pathologies liées à l’âge (ostéoporose, maladies cardiométaboliques et neurodégénératives, cancer, etc.), engendrant des coûts socioéconomiques considérables. Afin de réduire ces coûts, les stratégies thérapeutiques visant à inverser le vieillissement ou à prolonger la durée de vie en bonne santé sont devenues un objectif majeur de la recherche biomédicale. Le marché global des médicaments anti-âge dépassait déjà 49 milliards de dollars en 2022 et pourrait atteindre 95 milliards d’ici la fin de l’année 2033, selon Research Nester.
Les approches pharmacologiques dominent actuellement le domaine de recherche. Le marché est principalement accaparé par les médicaments ciblant des pathologies spécifiques liées au vieillissement. Cependant, ces approches n’offrent généralement que des avantages modestes. En conséquence, les stratégies innovantes, telles que la thérapie génique, gagnent toujours plus d’intérêt.
« La thérapie génique a le potentiel de cibler directement les causes génétiques ou épigénétiques sous-jacentes du vieillissement, tandis que les médicaments peuvent agir de manière moins spécifique », a expliqué dans un courriel à Trust My Science Ronald A. DePinho, titulaire de la chaire universitaire Harry Graves Burkhart III en recherche sur le cancer et ancien président du Centre de cancérologie MD Anderson de l’Université du Texas. « La thérapie génique pourrait [ainsi] avoir un impact durable », a-t-il ajouté.
« Facteurs Yamanaka » : une révolution pour la médecine du vieillissement
Les facteurs OSKM (ou Yamanaka) constituent l’une des plus grandes avancées de la médecine du vieillissement. Découverts en 2006 par le chercheur japonais Shinya Yamanaka (lauréat du prix Nobel de médecine 2012), ces facteurs — OCT4 (O), SOX2 (S), KLF4 (K) et c-MYC (M) — permettent de reprogrammer des cellules adultes spécialisées en cellules immatures capables de se différencier en n’importe quelle cellule, atteignant ainsi un état dit « pluripotent » — inversant le paradigme établi selon lequel la différenciation cellulaire est unidirectionnelle. Cette découverte a donné lieu au nouveau type de cellules souches appelées « cellules souches pluripotentes induites (iPS) ».
Depuis, de nombreuses stratégies de thérapies géniques ciblant les maladies liées au vieillissement explorent ces facteurs. « Contrairement aux thérapies qui ciblent des caractéristiques uniques du vieillissement (sénescence), la thérapie génique peut cibler les mécanismes fondamentaux sur plusieurs caractéristiques », indique DePinho. « L’édition génétique permet une approche personnalisée du profil génétique d’un individu, par exemple la correction d’une mutation provoquant la progéria », ajoute-t-il.
Lors d’expériences visant à stimuler temporairement ou cycliquement ces facteurs chez des modèles murins de la progéria, une extension de la durée de vie a été observée. D’autres études ont montré un rajeunissement du profil épigénétique suite à l’induction cyclique d’OKSM au niveau de plusieurs tissus, ainsi qu’une atténuation des lésions myocardiques post-infarctus.
Ces observations sur les facteurs Yamanaka ont fourni une base expérimentale solide pour les approches utilisant les facteurs OSKM. Cependant, la traduction de ces résultats en interventions thérapeutiques se heurte à deux défis majeurs : (i) le facteur Myc (M) est un puissant oncogène et sa surexpression peut induire le développement de tumeurs, (ii) l’OKSM est trop volumineux pour être adapté aux techniques d’administration de thérapies géniques existantes, telles que les vecteurs de virus adéno-associés (AAV).
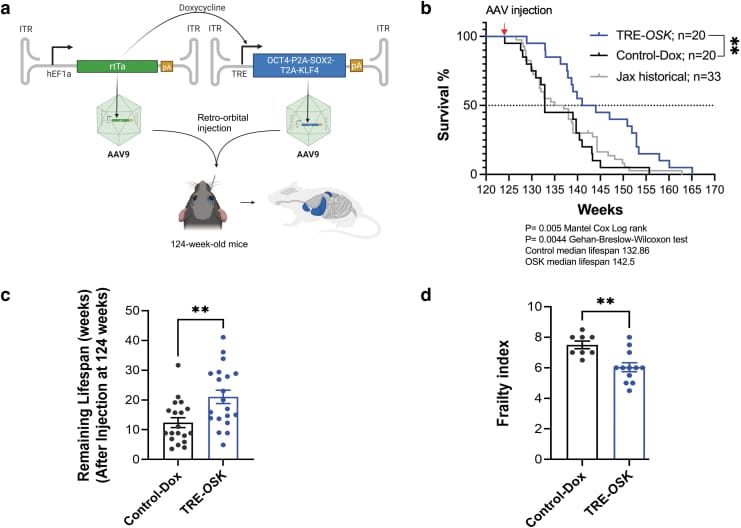
Afin de surmonter ces défis, des études se concentrent sur la reprogrammation cellulaire partielle n’utilisant qu’un sous-ensemble de facteurs Yamanaka, combinée à l’utilisation d’antibiotiques pour réduire le risque de formation de tumeurs. Chez les modèles murins progéroïdes, l’administration cyclique de doxycycline (un antibiotique de la famille des tétracyclines) parallèlement à une induction des OKSM a conduit à une reprogrammation partielle sans formation de tératome.
Une récente étude a montré des résultats prometteurs concernant la reprogrammation partielle basée sur trois facteurs : O, S et K. Ces derniers ont été administrés par voie systémique à des souris mâles très âgées (124 semaines, ou 77 ans en équivalent d’âge humain) par le biais d’AAV et parallèlement à de la doxycycline. La durée de vie des souris traitées a été prolongée de 109 % par rapport aux témoins, et leurs scores de fragilité ont été significativement améliorés. Au niveau des kératinocytes (des cellules épidermiques) humains où les OSK ont été induits, une augmentation significative des marqueurs épigénétiques du rajeunissement a été observée.
Des stratégies basées sur la reprogrammation épigénétique
Selon DePinho, « la reprogrammation épigénétique, utilisant une reprogrammation partielle à l’aide de facteurs de Yamanaka ou de facteurs spécifiques aux tissus qui modifient l’état cellulaire pour des maladies spécifiques aux tissus telles que l’arthrose », figure également parmi les approches les plus prometteuses en matière de thérapies géniques anti-vieillissement.
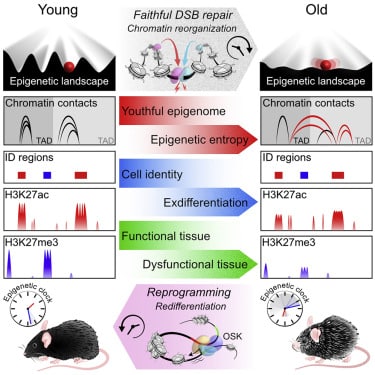
En effet, il a été suggéré que le vieillissement est davantage lié à une perte d’information épigénétique qu’à une accumulation de mutations génétiques. Si on considère que la vie repose sur des informations stockées au niveau des cellules, on pourrait comparer le génome à un support de stockage matériel, tandis que l’épigénome fonctionnerait comme le logiciel qui en orchestre l’utilisation.
Alors qu’on pensait initialement que le vieillissement résultait d’un dysfonctionnement matériel, cette hypothèse a été récemment remise en cause par des études montrant que des cellules vieillissantes présentent peu de mutations génétiques, tandis que d’autres avec des taux élevés de mutations n’affichent pas forcément de signes de vieillissement prématuré.
Une récente étude a renforcé l’hypothèse selon laquelle la perte d’informations épigénétiques est centrale dans le processus de vieillissement. Les chercheurs ont utilisé un système permettant de dégrader puis de restaurer les informations épigénétiques dans des cellules isolées et chez des souris. « Nous utilisons AAV9 [une variante d’AAV] pour cibler la plupart des tissus de la souris et montrons des preuves d’inversion de l’âge épigénétique dans les muscles et les reins », explique à Trust My Science David Andrew Sinclair, professeur titulaire au département de génétique du Paul F. Glenn Center for Biology of Aging Research de la Harvard Medical School, et cofondateur de Life Biosciences. L’inversion de la perte d’informations épigénétiques a été réalisée par l’induction des facteurs OSK.
Selon Sinclair, les cibles les plus prometteuses pour ces thérapies incluent les maladies oculaires, les maladies neurologiques et la fibrose. Concernant cette dernière, il serait utile d’illustrer par exemple le cas de la fibrose pulmonaire, où la perte de souplesse des tissus altère leur fonction respiratoire.
En octobre dernier, Life Biosciences a présenté des résultats prometteurs pour une thérapie génique reposant sur la reprogrammation épigénétique partielle induite par OSK pour le traitement de la neuropathie optique ischémique antérieure non artéritique, une maladie entraînant une perte de vision due à des lésions du nerf optique causées par une ischémie. Le traitement, administré par une seule injection intravitréenne associée à une prise quotidienne de doxycycline, a permis de protéger significativement la fonction visuelle. Ces résultats, observés à la fois en prévention et en traitement curatif, démontrent le potentiel de cette approche.
Inversion simultanée de plusieurs marqueurs du vieillissement
DePinho suggère que les composés activateurs de la transcriptase inverse de la télomérase (TAC) représentent une autre avancée majeure. Le raccourcissement des télomères constitue l’un des traits caractéristiques du vieillissement, en augmentant le taux de sénescence cellulaire. La transcriptase inverse de la télomérase (TERT) maintient la longueur des télomères.
D’après l’expert, certains TAC ont démontré une amélioration de la régénération tissulaire, de la fonction cognitive et des capacités physiques tout en évitant les niveaux excessifs associés au cancer. Une récente étude de son laboratoire a par ailleurs montré qu’un TAC spécifique réduit plusieurs marqueurs du vieillissement, notamment l’inflammation liée à l’âge et la perte des fonctions cérébrale et musculaire chez la souris.

Des fonctions cognitives et musculaires considérablement améliorées
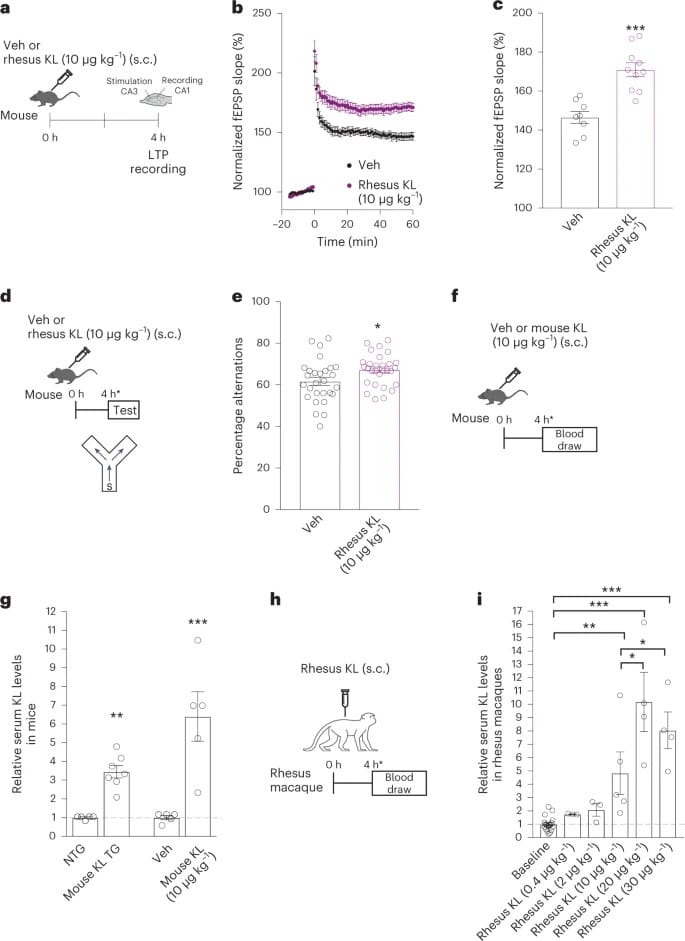
La protéine Klotho (KL), dont la mutation est associée à un vieillissement accéléré, représente également un domaine de recherche très actif. De nombreuses études montrent que le gène Klotho, qualifié « d’antivieillissement », diminue considérablement avec l’âge, notamment au niveau du cerveau des patients souffrant de maladies neurodégénératives comme Alzheimer. Les recherches se concentrent donc sur des thérapies visant à restaurer la santé cérébrale.
Klotho circule sous une forme hormonale issue du clivage de sa forme transmembranaire. Chez les souris, l’augmentation systémique de cette protéine par thérapie génique améliore la plasticité synaptique, la cognition et la résilience neuronale face au vieillissement. Toutefois, sa transposition aux humains reste complexe. Pour surmonter cette difficulté, des modèles animaux présentant une génétique et une anatomie cérébrale plus proches de celles des humains sont nécessaires.
Une récente étude a mené à la réalisation d’une avancée majeure en administrant la version spécifique de la protéine KL des macaques Rhésus, dont l’homologie avec la version humaine atteint 96 %. Ces primates, par ailleurs, partagent 93 % de similitude génétique avec l’espèce humaine, ce qui en fait des modèles pertinents.
Administrée par voie systémique, la KL des macaques Rhésus a permis d’améliorer la plasticité synaptique des souris en seulement quatre heures. Le protocole a ensuite été appliqué à des macaques Rhésus âgés en moyenne de 21,78 ans (l’équivalent de 65 ans pour un humain). Une seule injection à faible dose a suffi pour améliorer leurs fonctions cognitives, alors que l’administration à forte dose n’a pas montré de bénéfices similaires.
D’autres thérapies géniques visent à traiter des affections spécifiques comme la sarcopénie, caractérisée par une perte de masse et de force musculaire liée à l’âge. Par exemple, la follistatine, une protéine inhibant la myostatine (un régulateur négatif de la croissance musculaire), a montré des résultats prometteurs. Chez les souris, ce traitement a conduit à une hypertrophie musculaire marquée, améliorant le tonus et le poids des muscles. Chez des patients humains atteints de myosite à inclusions (une maladie dégénérative des muscles), il a permis une augmentation notable de la distance parcourue en six minutes : 56 mètres supplémentaires par an.
L’une des particularités de ce traitement est son contrôle : en cas d’effets secondaires, il peut être suspendu instantanément par l’administration de tétracycline. Bien que le traitement n’ait pas encore reçu l’approbation de la FDA, il est déjà inclus dans le programme expérimental du milliardaire de la tech Bryan Johnson, dont le style de vie anti-âge a été analysé dans un article précédent.
Les premiers traitements disponibles dans 10 à 15 ans ?
Malgré des avancées notables, les thérapies géniques anti-âge restent confrontées à la complexité des mécanismes du vieillissement. Comme le rappelle DePinho, « l’efficacité des thérapies dépend avant tout d’une compréhension fine des mécanismes pathologiques impliqués ». Or, ces derniers demeurent en partie incompris.
Dans le domaine des thérapies géniques, l’un des principaux défis est d’identifier et de cibler les gènes appropriés, une tâche particulièrement ardue puisque la plupart des maladies liées à l’âge sont polygéniques. À cela s’ajoutent des obstacles techniques : « Assurer un apport sûr et efficace de matériel génétique à des tissus spécifiques sans effets hors cible et éviter les réactions immunitaires aux vecteurs viraux ou aux transgènes thérapeutiques eux-mêmes sont les principaux enjeux », précise DePinho.
Malgré les stratégies visant à limiter le risque de formation de tumeurs, telles que l’utilisation partielle des facteurs Yamanaka, l’expression prolongée de certains gènes reste un facteur de risque. Selon DePinho, un potentiel cancérigène est presque systématiquement observé chez les souris pour les thérapies basées sur les facteurs OSKM.
Un autre défi réside dans la temporalité : « De longs délais sont nécessaires pour tester les médicaments visant à inverser le vieillissement chez l’homme », souligne l’expert. En effet, les modèles animaux utilisés pour ces recherches ont une durée de vie beaucoup plus courte et une complexité génétique limitée, ce qui ne permet pas de mesurer pleinement les effets à long terme chez l’être humain.
Néanmoins, les perspectives à court terme restent encourageantes. DePinho estime que les premières thérapies géniques ciblant des pathologies spécifiques liées à l’âge, telles que la sarcopénie ou Alzheimer, pourraient être disponibles d’ici 10 à 15 ans. Le laboratoire de David Sinclair prévoit, quant à lui, de lancer un essai clinique pour sa thérapie génique oculaire dès août 2025.
Si ce calendrier peut sembler lointain, il reste cohérent avec la durée moyenne de développement d’un médicament, estimée à environ 15 ans. Une fois ces premières thérapies ciblées validées, l’identification de biomarqueurs fiables du vieillissement permettra d’envisager des approches plus globales, comme la reprogrammation épigénétique à l’échelle de l’organisme.
Les deux experts s’accordent néanmoins à dire que les avancées futures dépendront principalement de la résolution des problèmes de sécurité, des défis réglementaires et des coûts inhérents à ces technologies. « La trajectoire actuelle suggère des progrès majeurs dans les deux prochaines décennies pour traiter le vieillissement, une maladie dont l’incidence et la mortalité atteignent toutes deux 100 % », conclut DePinho.