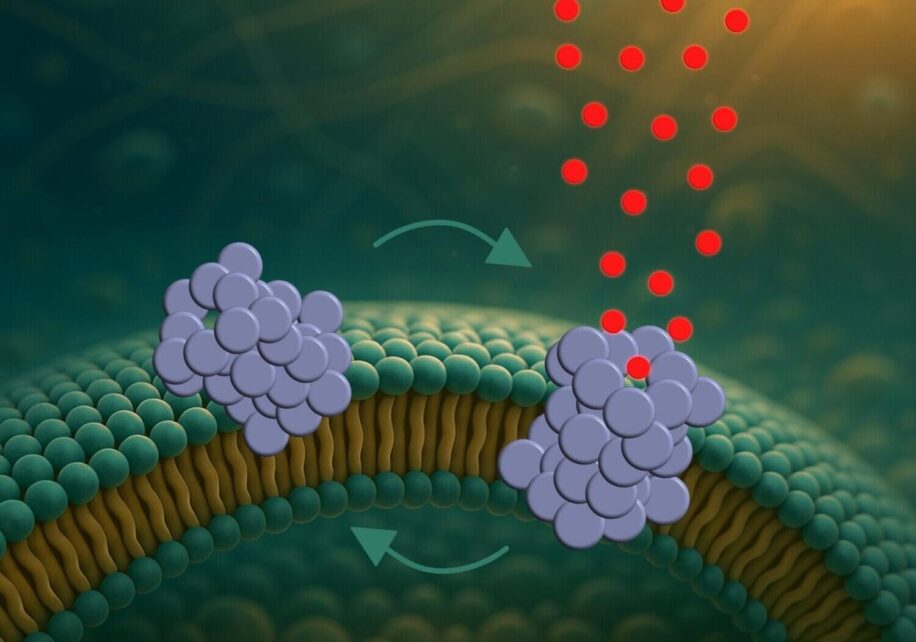
En effectuant des expériences sur des modèles cellulaires artificiels, des chercheurs ont découvert les oligomères d’alpha-synucléine, une protéine toxique impliquée dans la maladie de Parkinson, perce des trous dans la membrane des neurones. Provoquant des dommages progressifs, ces pores pourraient en partie expliquer les perturbations de la communication entre les neurones chez les personnes souffrant de la maladie.
La maladie de Parkinson est une pathologie neurodégénérative complexe dont l’étiologie exacte n’est pas encore entièrement élucidée. Elle se manifeste d’abord de façon discrète par de légers tremblements et une certaine raideur des membres, mais n’est généralement diagnostiquée qu’une fois les symptômes aggravés et les lésions neuronales déjà étendues.
Parmi les principaux facteurs suspectés figure l’accumulation de la protéine alpha-synucléine (α-synucléine). En temps normal, celle-ci joue un rôle essentiel dans la communication entre les neurones, en régulant le transport des vésicules synaptiques contenant les neurotransmetteurs. Toutefois, son mauvais repliement et son agrégation conduisent à la formation de structures toxiques appelées « corps de Lewy ». Ces agrégats perturbent la communication interneuronale et provoquent, à terme, leur perte, entraînant les symptômes neurodégénératifs typiques de la maladie de Parkinson.
La plupart des recherches se sont concentrées sur les agrégats protéiques volumineux, aisément identifiables dans les tissus cérébraux des personnes atteintes. La nouvelle étude, codirigée par l’Université d’Aarhus, au Danemark, s’est penchée sur les oligomères d’α-synucléine solubles, des structures plus petites et moins connues, mais qui pourraient être plus toxiques selon les résultats récemment publiés dans la revue ACS Nano.
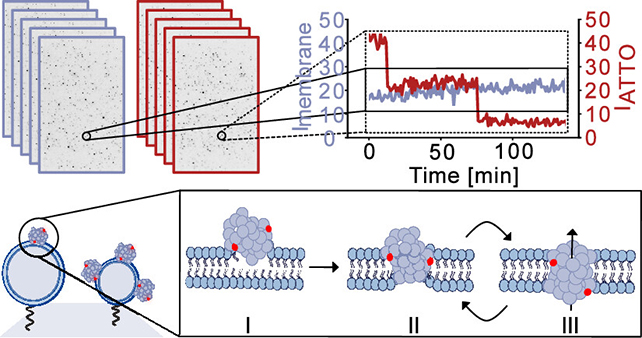
Un processus d’altération en trois étapes
Des travaux antérieurs avaient déjà montré que les oligomères d’α-synucléine affectent l’intégrité de la membrane neuronale. Ils modifient notamment la structure de la membrane lipidique enveloppant les cellules, ce qui les rendrait plus cytotoxiques que les agrégats protéiques plus volumineux.
L’intégrité de la membrane cellulaire est pourtant essentielle à la survie des cellules : elle constitue à la fois une barrière et une plateforme dynamique pour des processus biologiques tels que la signalisation chimique et la transduction d’énergie. Dans le contexte des maladies neurodégénératives, sa rupture est directement impliquée dans la perte de fonction neuronale et la mort cellulaire.
Mais si l’on savait déjà que les oligomères d’α-synucléine compromettaient les membranes, le mécanisme exact demeurait mal compris. Pour l’examiner en détail, l’équipe a conçu une plateforme d’analyse de vésicules individuelles : de minuscules billes lipidiques synthétiques, imitant les membranes cellulaires et servant de modèles simplifiés pour les cellules biologiques. Cette approche a permis de suivre finement les interactions moléculaires entre protéines et vésicules.
Les chercheurs ont constaté que les oligomères d’α-synucléine s’agrègent à la surface membranaire, puis y creusent des pores. Le processus se déroule en trois étapes : les protéines adhèrent à la membrane, puis la pénètrent partiellement. Elles forment ensuite des pores, laissant passer des molécules et perturbant l’équilibre chimique interne de la cellule.
« Nous sommes les premiers à observer directement comment ces oligomères forment des pores – et comment les pores se comportent », explique dans un communiqué de l’Université d’Aarhus Mette Galsgaard Malle, chercheuse postdoctorale à l’Université d’Aarhus et à Harvard, coauteure de l’étude.
Des pores dynamiques provoquant des dommages progressifs
Ces pores se révèlent dynamiques : ils s’ouvrent et se referment aléatoirement, à la manière de petites portes tournantes. Selon Bo Volf Brøchner, doctorant à l’Université d’Aarhus et auteur principal de l’étude, « ce comportement dynamique pourrait expliquer pourquoi les cellules ne meurent pas immédiatement ». Si les pores restaient ouverts en permanence, les cellules se rompraient rapidement. Leur ouverture et fermeture intermittentes permettent toutefois aux pompes présentes dans les membranes de compenser temporairement le déséquilibre.
Autre observation : les membranes les plus courbées, comme celles des mitochondries, se révèlent particulièrement vulnérables à l’adhésion des protéines et à la formation de pores. Un constat qui pourrait nourrir de nouvelles stratégies thérapeutiques ciblant ces organites.
Les chercheurs ont déjà testé des nanocorps, de petits fragments d’anticorps capables de se lier spécifiquement aux oligomères. Mais si ces particules se sont montrées prometteuses pour détecter la protéine, elles n’ont pas empêché la formation des pores.
De nouvelles recherches s’imposent donc avant d’envisager un développement thérapeutique. Les résultats obtenus reposent sur des modèles synthétiques, et non sur des cellules biologiques. L’étape suivante consistera à vérifier leur validité dans des tissus biologiques, où l’environnement est beaucoup plus complexe.
« Nous avons créé un dispositif expérimental propre qui nous permet de mesurer un élément à la fois. C’est là toute la force de cette plateforme », souligne Mette Galsgaard Malle. « Mais nous devons maintenant passer à l’étape suivante et étudier ce qui se passe dans des systèmes biologiques plus complexes », conclut-elle.