Des chercheurs ont converti des cellules cutanées en ovules fécondables en induisant un processus appelé « mitoméiose », qui imite la division cellulaire naturelle. Cette approche permettrait d’obtenir un gamète fonctionnel en entraînant l’élimination du jeu de chromosomes supplémentaire présent dans les cellules somatiques. Ces résultats suggèrent que la reprogrammation cellulaire pourrait un jour constituer une alternative pour traiter l’infertilité.
Affectant des millions de personnes dans le monde, l’infertilité est causée par l’incapacité à produire des gamètes (spermatozoïdes ou ovules) fonctionnels. Chez les femmes, la baisse liée à l’âge de la qualité et de la quantité d’ovocytes constitue l’une des principales causes d’infertilité. Et si la fécondation in vitro (FIV) a connu des avancées notables au cours des dernières décennies, elle reste inefficace chez les patientes dépourvues de gamètes fonctionnels.
Des études suggèrent que la reprogrammation de cellules somatiques (qui n’appartiennent pas à la lignée germinale comme les gamètes) pourrait permettre de produire des gamètes fonctionnels. Elles seraient reprogrammées en cellules souches pluripotentes induites (pouvant se différencier en n’importe quelle cellule), afin de pouvoir se différencier en spermatozoïdes ou en ovocytes. Ce concept, appelé « gamétogenèse in vitro » (GIV), pourrait offrir une alternative thérapeutique aux patients ne pouvant produire de gamètes viables.
La faisabilité de la technique a été démontrée chez des modèles murins femelles. La reproductibilité sur les humains se heurte cependant à des défis importants, liés principalement aux différences dans le développement des cellules germinales entre la souris et l’humain.
L’approche consiste à transférer le noyau d’une cellule somatique à l’intérieur d’un ovule de donneuse préalablement énucléé. La cellule obtenue peut alors se développer en ovocyte, après un processus de maturation. Cependant, si les gamètes conventionnels ne possèdent que la moitié du nombre habituel de chromosomes (un jeu de 23 chromosomes ou cellules haploïdes), ceux produits à partir du transfert de noyau de cellules somatiques contiennent deux jeux de chromosomes (46 chromosomes ou cellules diploïdes). Autrement dit, ces gamètes possèdent un jeu de chromosomes supplémentaire.
Une technique permet de retirer ce jeu de trop, mais son efficacité n’a été démontrée que sur des cellules de modèles murins. L’équipe codirigée par l’Oregon Health & Science University, à Portland, propose une nouvelle approche permettant d’extraire ce jeu supplémentaire des cellules humaines. Les résultats de la recherche sont publiés aujourd’hui dans la revue Nature Communications.
9% de fécondation sur 82 ovocytes fonctionnels
Afin de produire des gamètes femelles, l’équipe de la nouvelle étude a effectué une GIV sur des cellules cutanées somatiques humaines. Les chercheurs ont ensuite induit un processus appelé « mitoméiose », imitant la division cellulaire naturelle, pour éliminer le jeu de chromosomes de trop.
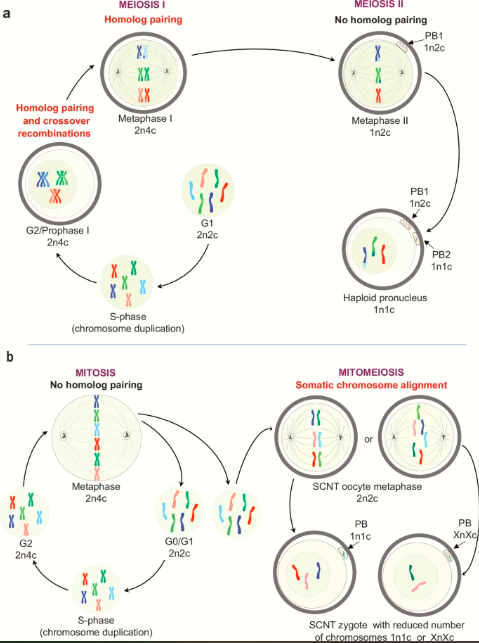
« Pour remédier à la réduction de la ploïdie, nous avons étudié un processus expérimental de division cellulaire réductrice, appelé mitoméiose, dans lequel les génomes somatiques non répliqués sont prématurément forcés à se diviser après transplantation dans le cytoplasme métaphasique d’ovocytes humains énucléés », expliquent les chercheurs dans leur document.
Lorsque l’approche a été utilisée chez les souris, dans le cadre d’une étude antérieure, les chromosomes en forme de fuseau au début de la métaphase ont éliminé un groupe d’homologues parentaux lors de la fécondation par des spermatozoïdes. Les zygotes obtenus se sont développés avec succès en embryons diploïdes, qui ont donné naissance à des souris vivantes.
« Dans cette [nouvelle] étude, nous avons adapté la mitoméiose aux ovocytes humains et avons examiné si les fuseaux métaphasiques sont fonctionnels et capables d’éliminer les chromosomes somatiques lors de la fécondation ou d’une activation artificielle », indique l’équipe.
Une technique de séquençage chromosomique a été utilisée afin de suivre la ségrégation des chromosomes homologues et analyser les mécanismes de la réduction de la ploïdie. Les chercheurs ont également évalué le taux d’intégration des chromosomes somatiques et spermatiques dans les embryons obtenus.
Sur 82 ovocytes fonctionnels, 9% ont été fécondés avec succès et ont atteint le stade blastocyste au sixième jour. Cependant, aucun des blastocystes n’a évolué au-delà de ce stade, qui correspond généralement au moment où les embryons sont transférés dans l’utérus lors d’une FIV. Des anomalies chromosomiques ont également été observées chez la plupart des blastocystes.
« Bien que notre étude démontre le potentiel de la mitoméiose pour la gamétogenèse in vitro, elle ne constitue à ce stade qu’une preuve de concept et des recherches supplémentaires sont nécessaires pour garantir son efficacité et sa sécurité avant de futures applications cliniques », conclut l’équipe.