La compréhension des mécanismes évolutifs à l’oeuvre chez les bactéries est d’une grande importance pour les biologistes, car elle permet entre autre, de développer de nouvelles contre-mesures visant à enrayer la résistance aux antibiotiques toujours plus inquiétante chez les bactéries pathogènes. Dans ce cadre, des chercheurs ont pu observer pour la première fois des bactéries « harponner » des fragments d’ADN de leur milieu, afin d’accélérer ce processus évolutif.
Depuis plusieurs années, la résistance aux antibiotiques des bactéries pathogènes est un important sujet d’inquiétude pour les politiques publiques internationales. L’utilisation à outrance de molécules antibiotiques a permis le développement de bactéries super-résistantes posant aujourd’hui un véritable problème de santé publique. Cela est rendu possible par les mécanismes évolutifs utilisés par les bactéries, qui sont capables de modifier et complexifier leur génome sur des périodes de temps très brèves.
Une équipe de microbiologistes américains de l’université de l’Indiana a observé, pour la première fois en direct, un de ces mécanismes chez Vibrio cholerae, la bactérie responsable de la maladie du choléra. Le pathogène a projeté l’un de ses appendices dans le milieu environnant afin « d’harponner » un morceau d’ADN dans le but de l’intégrer à son génome. Les résultats et l’analyse de l’observation ont été publiés dans la revue Nature Microbiology.
L’appendice en question est appelé « pilus » et se situe à la surface de la paroi de nombreuses bactéries. Ils se distinguent des flagelles en ce qu’ils ne sont pas impliqués dans la mobilité bactérienne. Il existe trois types de pilus : des pili communs servant à l’adhésion cellulaire et participant donc au pouvoir pathogène bactérien ; des pilis sexuels intervenant dans la conjugaison bactérienne (échange d’informations génétiques entre bactéries) et impliqués dans la transmission de la résistance aux antibiotiques ; des pilis électroconducteurs permettant à certaines bactéries de capturer des électrons de leur milieu.
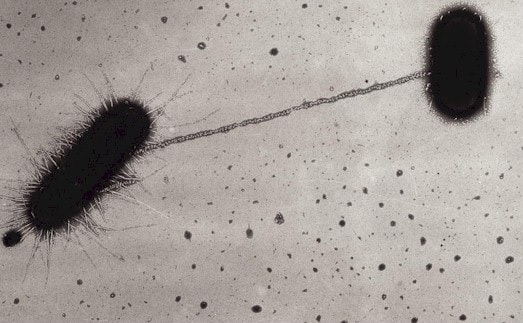
Dans ce cas-ci, ce sont donc leurs pili sexuels que les bactéries ont utilisé pour capturer l’ADN alentour. Le processus par lequel une bactérie intègre de nouvelles informations génétiques provenant d’un organisme différent à son génome s’appelle un « transfert horizontal de gènes » (par opposition au transfert vertical, où le donneur est l’ancêtre). Bien que théorisé depuis plusieurs dizaines d’années, c’est la première fois que des scientifiques ont pu observer en direct un tel transfert effectué par pilus.
« Le transfert horizontal de gènes est un important moyen de transmission de résistance aux antibiotiques entre les espèces bactériennes, mais le processus n’a jamais été observé auparavant, puisque les structures bactériennes impliquées sont extrêmement petites. C’est important de comprendre ce mécanisme, car plus nous en savons sur la manière dont les bactéries partagent leur ADN, plus nous pouvons le contrer » explique le biologiste Ankur Dalia.
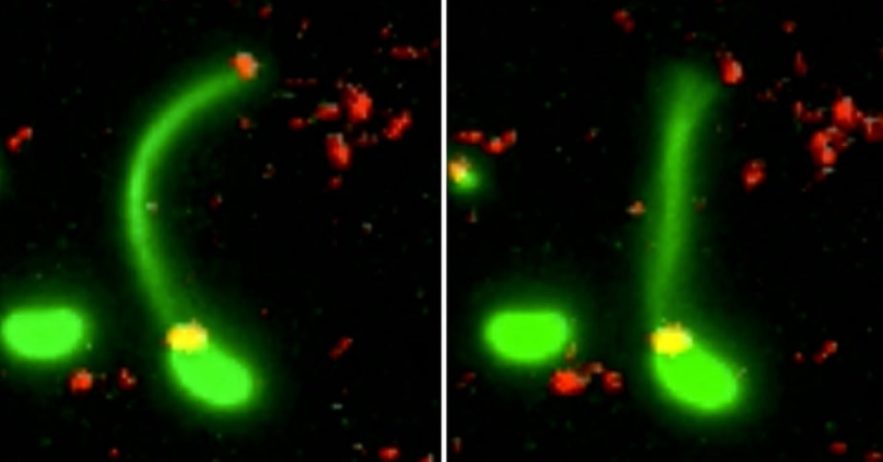
La manière dont une bactérie utilise ses pili est encore peu comprise car ces derniers sont extrêmement petits ; un pilus est 10’000 fois plus petit qu’un cheveux humain. Pour cette raison, les chercheurs ont employé une méthode visant à rendre fluorescents la bactérie, ses pili et l’ADN. Une fois placé sous le microscope, cet échantillon fluorescent a permis aux scientifiques d’observer en direct le processus par lequel une bactérie capture un morceau d’ADN du milieu extérieur pour l’intégrer à son génome.
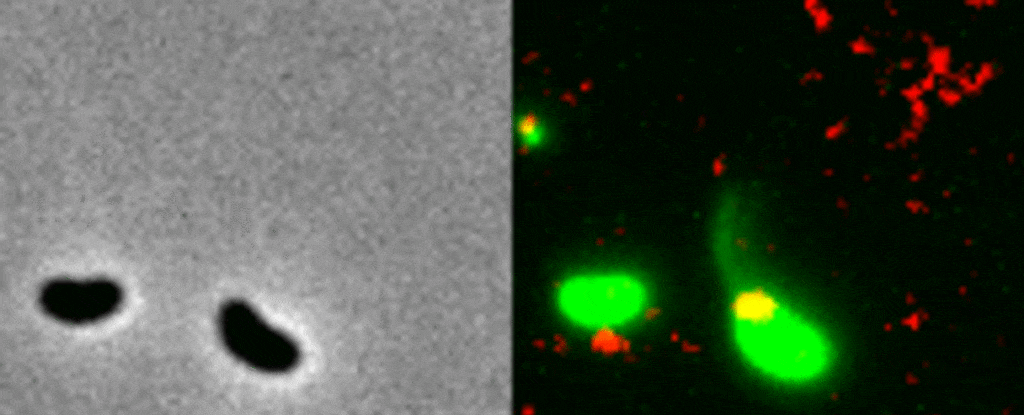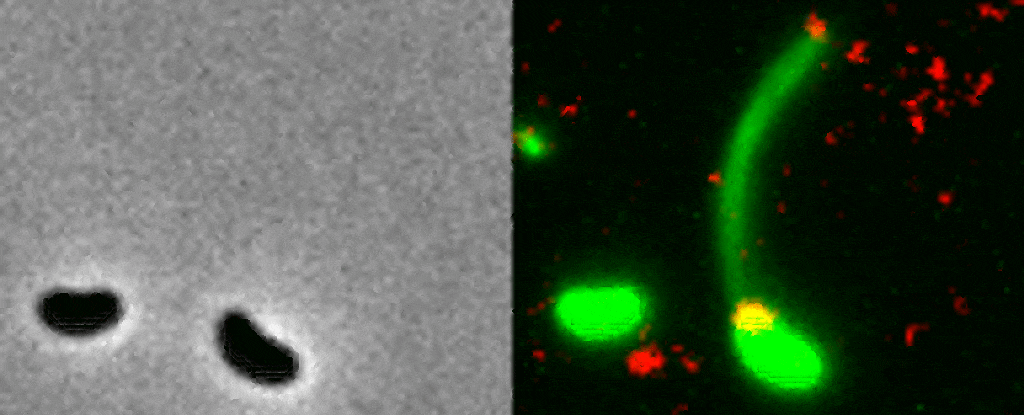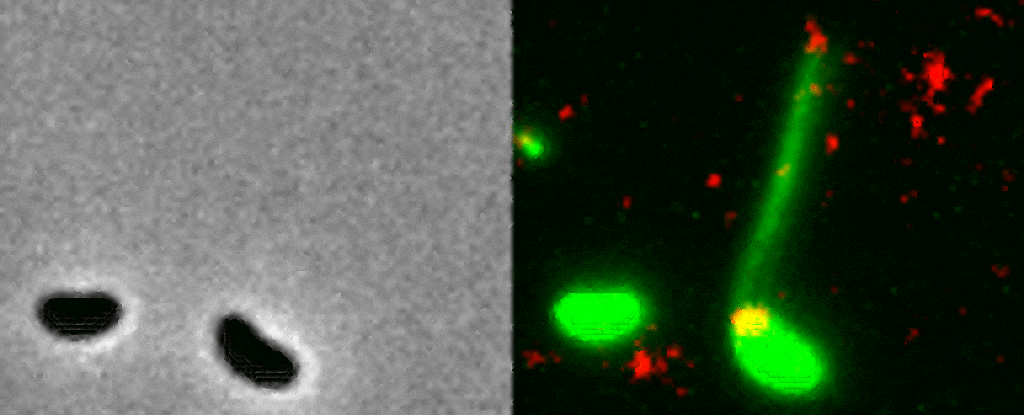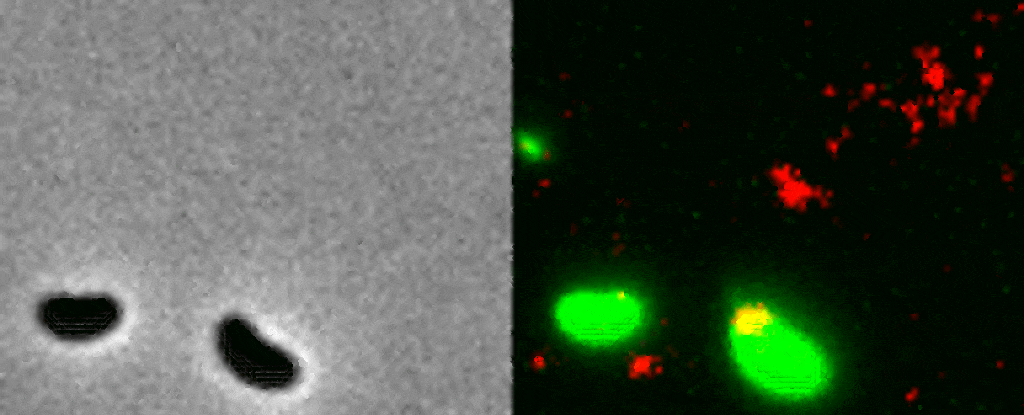
Le pilus est projeté à travers un pore de la paroi bactérienne pour capturer un morceau d’ADN, puis il se rétracte avec une grande précision.« C’est comme enfiler une aiguille. La taille du pore de la membrane extérieure correspond presque exactement à celle d’une hélice d’ADN pliée en deux, ce que semble avoir attrapé la bactérie. Si le pilus n’était pas là pour la guider, la probabilité que l’ADN atteigne le pore au bon moment et avec le bon angle pour traverser la paroi, est proche de zéro » explique la biologiste Courtney Ellison.
Le transfert de la résistance aux antibiotiques peut être réalisé de plusieurs façons, et le transfert horizontal de gène est l’un d’eux. Un tel mécanisme n’a pas nécessairement lieu entre deux bactéries vivantes, des bactéries mortes peuvent également servir de source génétique. Dans ce cas-là, le processus est nommé « transformation ». Lorsqu’une bactérie meurt, se paroi se lyse (se détruit) et libère l’ADN qu’elle contient dans le milieu ; si cet ADN possède des gènes impliqués dans la résistance aux antibiotiques, alors la bactérie qui le capture développe à son tour cette résistance.
Comprendre les mécanismes de développement et transmission de résistance aux antibiotiques est donc capital pour mettre au point des moyens de les contrer. La prochaine étape pour les scientifiques est de savoir comment la bactérie parvient à trouver le morceau d’ADN et à projeter son pilus à l’endroit exact où il se trouve ; ils doivent également déterminer la manière dont le pilus fixe l’ADN, puisque c’est la première fois qu’ils observent un tel processus d’adhésion de la part des protéines constituant le pilus.
Les chercheurs ambitionnent également d’utiliser leur méthode pour comprendre les autres fonctions des pili. « Ce sont des appendices très versatiles, cette nouvelle méthode nous permet d’améliorer notre connaissance concernant les fonctions bactériennes » conclut Dalia.