L’électron est une particule élémentaire qui, avec les protons et les neutrons, constitue les atomes. C’est donc l’un des composants principaux de la matière baryonique. À ce titre, il revêt une importance fondamentale tant en chimie, où il intervient dans les liaisons moléculaires et la majorité des réactions chimiques, qu’en physique où il est impliqué dans un très grand nombre de phénomènes tels que la conductivité électrique ou la supraconductivité.
Au début de 19ème siècle, l’électron et sa charge sont encore perçus comme un phénomène continu de la matière. Il faut attendre la fin des années 1830 et les travaux du chimiste britannique Richard Laming pour que le concept d’une quantité de charge électrique indivisible émerge. En 1897, la nature corpusculaire de l’électron se précise grâce aux travaux du physicien britannique Joseph J. Thompson sur les tubes cathodiques.
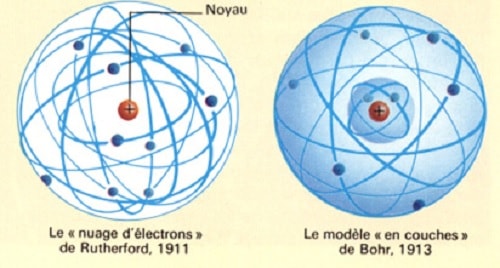
Par la suite, au début du 20ème siècle, l’étude de l’électron va connaître un essor spectaculaire : les travaux d’Albert Einstein sur l’effet photoélectrique, l’introduction par Niels Bohr de son modèle atomique, les expériences de Rutherford sur les particules alpha, la démonstration de la diffusion Compton, l’introduction du spin de l’électron par Wolfgang Pauli, la dualité onde-corpuscule de Louis de Broglie, l’équation de Schrödinger en 1926 et la publication de l’équation de Dirac en 1928.
À la fin des années 1940, notamment grâce aux travaux de Richard Feynman, l’électron est incorporé dans une théorie quantique complète appelée l’électrodynamique quantique.
Pour approfondir :
La forme de l’électron à l’origine du déséquilibre matière-antimatière ?
Dans le Modèle Standard des particules, l’électron est un fermion et plus précisément un lepton, c’est-à-dire une particule élémentaire de spin 1⁄2 insensible à l’interaction nucléaire forte. Il possède une charge électrique négative égale à -1.602 × 10−19 C (Coulombs) notée « e–», ainsi qu’une masse égale à 9.109 × 10-31 kg, soit une énergie de 511 keV (kilo-électronvolts) selon le principe d’équivalence masse-énergie. Il s’agit de la particule la plus légère de toutes les particules chargées. Sa durée de vie théorique a été estimée expérimentalement supérieure à 2.1×1036 s.

L’électron est sensible à la gravitation, à l’interaction électromagnétique et à l’interaction nucléaire faible. Un électron est la source d’un champ électrique attractif (particules chargées positivement) ou répulsif (particules chargées négativement) dont l’intensité est déterminée grâce à la loi de Coulomb. Lorsqu’il est en mouvement, l’électron est également source d’un champ magnétique dont la valeur est déterminée par la loi de Maxwell-Ampères. Lorsqu’il se déplace au sein d’un champ magnétique, il subit la force de Lorentz.
Les niveaux d’énergie que peuvent occuper les électrons dans un atome sont quantifiés. Ces niveaux d’énergie, qui correspondent aux couches électroniques du modèle de Bohr, sont en réalité une conséquence de la dualité onde-corpuscule à laquelle répond l’électron. La description de cette nature ondulatoire de la matière passe par l’équation de Schrödinger, dont la généralisation à l’électron est l’équation de Dirac. La position d’un électron dans un atome est ainsi donnée par une distribution de probabilités représentée par une orbitale atomique et obtenue à partir de la fonction d’onde de l’électron.
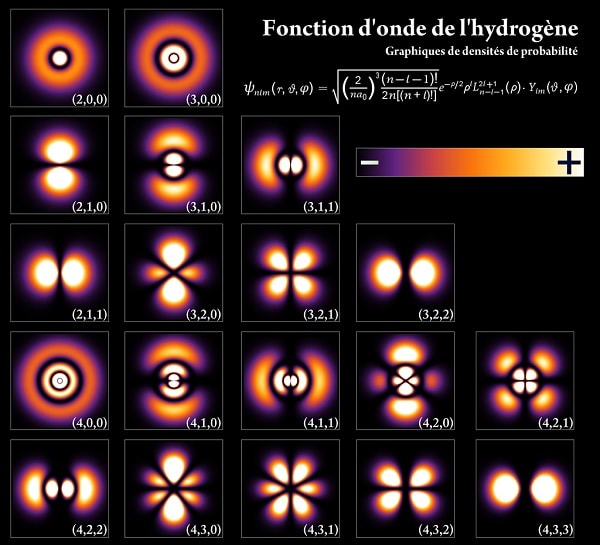
Un électron peut être lié à un noyau atomique ou être libre. Dans le premier cas, c’est la force de Coulomb attractive qui le relie au noyau — le noyau atomique est chargé positivement via les protons qui le constituent. Un électron peut passer d’un niveau d’énergie à un autre en absorbant ou en émettant un photon d’énergie définie. Un électron peut être arraché à un atome lorsque son énergie dépasse son énergie d’ionisation.
L’électron joue un rôle primordial dans les liaisons chimiques, c’est-à-dire les liaisons inter-atomiques. Il existe deux types d’électrons : les électrons de cœur — les électrons très fortement liés au noyau atomique non-impliqués dans les liaisons chimiques, et les électrons de valence (les électrons situés sur la dernière couche d’un atome (couche de valence) impliqués dans les liaisons chimiques). De même, le transfert d’électrons est à la base des réactions d’oxydoréduction omniprésentes en physique et en chimie.