Construites de A à Z par les scientifiques, des cellules synthétiques et autres créations, pourraient bientôt tester les limites de la vie. Il n’y avait que huit ingrédients : deux protéines, trois agents tampons, deux types de molécules de graisse, et de l’énergie chimique. Ces éléments ont suffi pour créer une véritable flotte de blobs pulsants et rebondissants : des structures rudimentaires en forme de cellules, avec certains des mécanismes nécessaires pour se diviser par eux-mêmes.
Pour la biophysicienne Petra Schwille, les créations de son laboratoire représentent une étape importante dans la construction d’une cellule synthétique de A à Z. Un objectif sur lequel elle travaille depuis maintenant dix ans, et plus récemment à l’Institut de biochimie Max Planck de Martinsried, en Allemagne. « J’ai toujours été fascinée par cette question : « Qu’est-ce qui distingue la vie de la matière non vivante ? » », explique Schwille. Selon elle, le défi consiste à déterminer quels composants sont nécessaires pour créer un système vivant.
Cela fait plus de 20 ans que les chercheurs du monde entier tentent de créer des cellules artificielles en assemblant des biomolécules dans un contexte approprié, afin d’approcher différents aspects de la vie. Bien que ces aspects soient nombreux, ils appartiennent généralement à trois catégories : la compartimentation ou la séparation de biomolécules dans l’espace, le métabolisme (la biochimie qui soutient la vie), et le contrôle de l’information, comprenant le stockage et la gestion des instructions cellulaires.
Cependant, (en partie) grâce aux progrès récents des technologies microfluidiques, qui permettent aux scientifiques de coordonner les mouvements de composants cellulaires minuscules, le rythme des travaux s’est accéléré.
Des groupes de recherche ont déjà déterminé des moyens de sculpter ces blobs, ressemblant à des cellules, aux formes souhaitées. Cela a donc permis aux scientifiques de créer des versions rudimentaires du métabolisme cellulaire ainsi que de transplanter des génomes fabriqués à la main, dans des cellules vivantes. Mais réunir tous ces éléments reste un grand défi technique.
En septembre 2017, des chercheurs de 17 laboratoires néerlandais ont formé le groupe Building a Synthetic Cell (BaSyC), qui vise à construire un « système semblable à une cellule, croissant et se divisant » d’ici dix ans, selon la biophysicienne Marileen Dogterom, directrice du BaSyC et qui gère un laboratoire à l’Université de technologie de Delft. Ce projet est alimenté par une subvention néerlandaise de 18.8 millions d’euros.
En septembre dernier, la US National Science Foundation (NSF) a annoncé le lancement de son premier programme sur les cellules synthétiques, financé à hauteur de 9 millions d’euros.
De plus, plusieurs chercheurs européens, dont Schwille, ont proposé de construire une cellule synthétique dans le cadre de l’un des programmes phares de la Commission européenne en matière de technologies futures et émergentes. Ce programme bénéficie d’un financement d’un milliard d’euros. Les biologistes synthétiques prédisent actuellement que les premières cellules entièrement artificielles pourraient voir le jour d’ici moins d’une décennie. « Je suis presque sûre que nous y arriverons », déclare Schwille.
Récemment, des groupes de recherche ont fait de grands progrès en recréant plusieurs aspects de la vie cellulaire, en particulier en arrivant à imiter les membranes qui entourent les cellules et compartimentent les composants internes de ces dernières. En effet, il faut savoir que l’organisation moléculaire est la clé pour les amener à travailler ensemble, au bon endroit et au bon moment. De plus, certains composants doivent être séparées et d’autres rassemblés. « Pour moi, il s’agit de sociologie des molécules », explique Cees Dekker, biophysicien à l’Université de technologie de Delft.
Cela signifie pour la plupart, d’organiser les biomolécules sur ou dans les membranes lipidiques. Fort heureusement, Schwille et son équipe sont experts en membranes. Les chercheurs ont utilisé des techniques microfluidiques pour construire des récipients à membrane de la taille d’une cellule (ou liposomes) capables de tolérer de multiples insertions de protéines dans les membranes elles-mêmes.
Le groupe de recherche de Schwille souhaite capitaliser sur sa connaissance de ces protéines (les protéines Min), qui peuvent produire des modèles de membrane et s’auto-organiser. « Nous comprenons très bien ces molécules. Nous aimerions voir jusqu’où nous pouvons aller avec des éléments relativement simples », dit-elle. Peut-être, comme le suggère le travail de Litschel (étudiant diplômé de Schwille), que l’équipe pourrait utiliser ces protéines pour mouler des membranes en vue de la division, ou pour rassembler des composants à une extrémité d’une cellule synthétique. Schwille espère que ces molécules utiles lui donneront la capacité d’élaborer des structures semblables à des cellules.
Les membres de l’équipe de Dekker ont également rempli les liposomes de leurs protéines à l’aide d’une puce microfluidique. Sur la puce en question, deux canaux contenaient des molécules lipidiques convergeant sur un canal rempli d’eau et crachant des liposomes de la taille d’une cellule (pouvant contenir diverses molécules biologiques), soit collés à travers la membrane, soit flottant librement à l’intérieur du conteneur. Ce groupe de recherche a expérimenté la mise sous pression, la déformation et le remodelage des liposomes pour leur donner des formes non sphériques, qui imitent donc mieux les cellules.
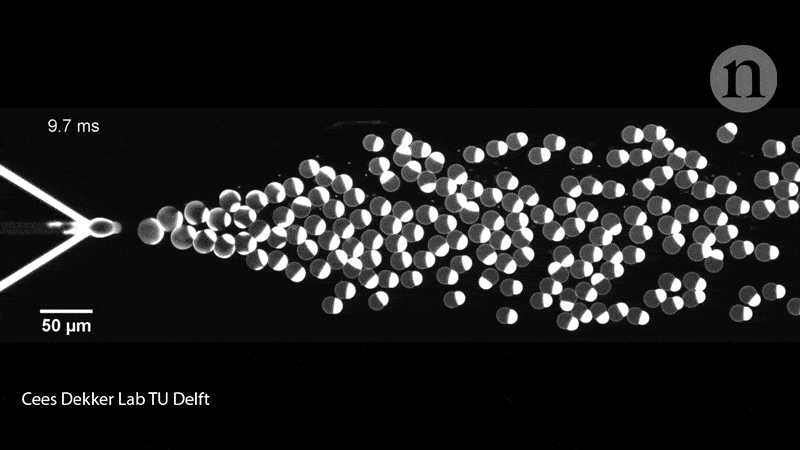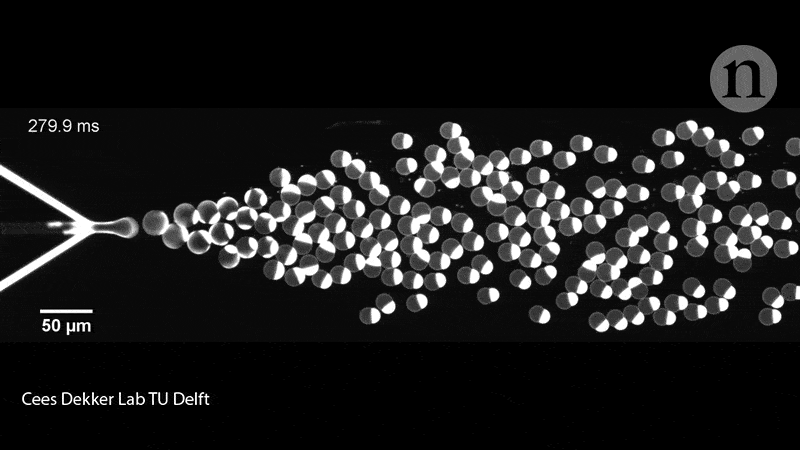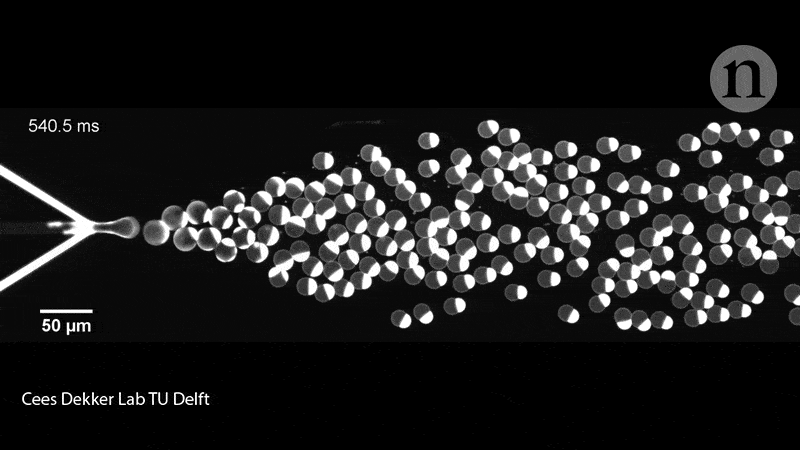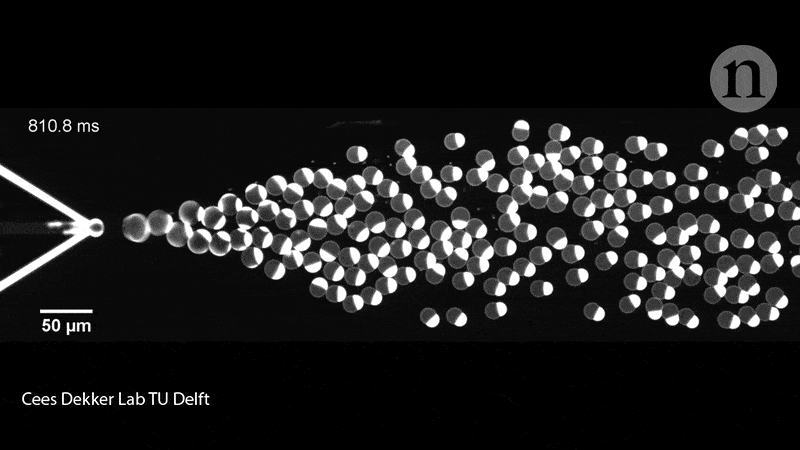
En effet, il faut savoir que ces dispositifs microfluidiques donnent aux chercheurs plus de contrôle pour déplacer, trier et manipuler les liposomes à l’aide de micro-canaux fonctionnant presque comme des circuits. « Ceci, n’est bien entendu pas ce que nous recherchons dans un premier temps – nous souhaitons démontrer la division de l’intérieur, mais cela nous donne tout de même des informations intéressantes », déclare Dekker. Les exemples incluent la force nécessaire pour diviser une cellule et les types de manipulation physique que les liposomes peuvent tolérer.
Vous aimerez également : Des neuroscientifiques ont découvert une différence dans les cellules cérébrales humaines les rendant uniques
L’équipe de recherche a également joué avec la forme des cellules vivantes (des cellules de Escherichia coli, plus connue sous le nom abrégé E. Coli), les rendant plus larges ou carrées, en les cultivant dans des chambres de silicone nanofabriquées.
De cette manière, les membres de l’équipe ont pu constater comment la forme des cellules affecte les mécanismes de division et évaluer comment les protéines Min agissent dans des cellules de tailles et de formes différentes. « Nous exploitons des techniques de nanofabrication et faisons des choses qu’un biologiste cellulaire ‘’normal’’ ne ferait jamais. Mais un biophysicien étrange comme moi, peut le faire », explique Dekker.
Maintenant qu’il est possible d’ajouter des composants aux véritables bulles de liposomes sans les faire éclater, les groupes de recherche peuvent planifier la mise en réseau des molécules.
Presque tout ce qui ressemble à la vie nécessite de l’énergie cellulaire, généralement sous forme d’ATP — l’adénosime triphosphate, qui fournit l’énergie nécessaire aux réactions chimiques du métabolisme, à la locomotion, à la division cellulaire ou encore au transport actif d’espèces chimiques à travers les membranes biologiques. Et bien que cela puisse être ajouté de l’extérieur pour alimenter un système synthétique, de nombreux biologistes travaillant sur des approches ascendantes, affirment qu’une vraie cellule synthétique devrait avoir sa propre centrale (soit un système similaire à la mitochondrie d’une cellule animale ou au chloroplaste d’une plante) qui produit son propre ATP.
Le groupe de Joachim Spatz, de l’Institut Max Planck de recherche médicale de Heidelberg, en Allemagne, a construit une mitochondrie rudimentaire pouvant créer de l’ATP dans une vésicule. Les chercheurs ont chargé des membranes avec une enzyme appelée ATP synthase, qui permet de créer de l’énergie ATP.
Un autre groupe de chercheurs en biologie synthétique, de Max Planck, et dirigé par le biochimiste Tobias Erb, s’est intéressé à d’autres approches de la construction de voies métaboliques cellulaires. Ce groupe de chercheurs s’intéresse particulièrement aux voies qui permettent aux microbes photosynthétiques d’extraire le dioxyde de carbone de l’environnement, et de fabriquer des sucres, ainsi que d’autres éléments constitutifs des cellules.
Lors de leurs études, Erb et son équipe ont décidé d’adopter une approche simpliste pour synthétiser les voies métaboliques cellulaires : « Du point de vue de l’ingénierie, nous réfléchissons dans un premier temps à la manière de concevoir, puis nous le construisons effectivement dans le laboratoire », explique Erb. En effet, son équipe a mis au point un système capable de convertir le CO2 en malate (métabolite clé produit lors de la photosynthèse). Selon les chercheurs, cette méthode pourrait être encore plus efficace que la photosynthèse elle-même.
Finalement, l’équipe d’Erb a découvert 17 enzymes provenant de 9 organismes différents, dont E. coli, un archéon, la plante Arabidopsis et les humains. Les chercheurs n’ont pas été surpris de voir que la réaction a été très inefficace et lente. « Nous avons mis en place une équipe d’enzymes qui ne fonctionnaient pas bien ensemble », explique Erb. Mais heureusement, l’équipe ne s’est pas laissée abattre par cet échec. Après de plus amples recherches, les chercheurs ont finalement réussi a mettre au point une méthode qui, selon Erb, serait 20% plus efficace que la photsythèse.
En élargissant ses travaux, le groupe d’Erb a commencé à construire une version brute d’un chloroplaste synthétique : c’est en broyant des épinards dans un mélangeur et en ajoutant des mécanismes de photosynthèse à leur système enzymatique, dans le tube à essai, que les biologistes ont pu stimuler la production d’ATP et la conversion de CO2 en malate (mais ce, uniquement en projetant une lumière ultraviolette).
Le groupe d’Erb, collabore également avec d’autres biologistes synthétiques, tels que Kate Adamala, qui peuvent construire et contrôler des compartiments complexes (qui agissent comme un chloroplaste, ce que Erb souhaiterait effectuer dans ses recherches).
Le groupe de recherche d’Adamala, à l’Université du Minnesota à Minneapolis (USA), étudie des moyens de construire des bioréacteurs programmables en introduisant des circuits génétiques simples dans des liposomes, puis, en les fusionnant, créer des bioréacteurs plus complexes encore. Adamala les appelle « des bulles de savon qui fabriquent des protéines ».
Cette dernière et son groupe construisent ces bioréacteurs en utilisant un système de tube rotatif similaire à celui de Schwille, mais qui produit des liposomes plus petits. Les chercheurs ont ensuite ajouté des cercles d’ADN appelés plasmides, qu’ils ont conçu pour remplir une fonction particulière, ainsi que tous les mécanismes nécessaires à la fabrication de protéines à partir d’ADN. Par exemple, les chercheurs ont fabriqué des bioréacteurs à liposomes capables de détecter un antibiotique dans leur environnement, à travers les pores de la membrane, et de générer un signal bioluminescent en réponse à cela.
Puis, en fusionnant séquentiellement ces bioréacteurs simples, l’équipe peut construire des circuits génétiques plus complexes. Cependant, les systèmes commencent à s’effondrer à mesure qu’ils se développent pour inclure une dizaine de composants.
Pour Adamala, il s’agit là d’un défi majeur dans ce domaine. En effet, dans une vraie cellule, les protéines qui pourraient interférer les unes avec les autres sont séparées par une variété de mécanismes.
Pour les cellules synthétiques (qui sont beaucoup plus simples), les biologistes doivent trouver d’autres moyens d’imposer ce contrôle. Cela pourrait se faire par un contrôle externe par exemple, dans lequel l’expérimentateur décide quels liposomes doivent être mélangés et à quel moment. Cela pourrait également être accompli par des éléments chimiques qui régulent les liposomes qui peuvent fusionner, ou encore par le biais d’un système à libération progressive.
Un autre élément clé pour créer une cellule, est d’obtenir le bon logiciel. Afin de permettre à une cellule synthétique de suivre les instructions des scientifiques et de se répliquer, il faudra un moyen de stocker et de récupérer des informations. Pour les systèmes vivants, cela se fait par les gènes (allant de quelques centaines pour certains microbes à des dizaines de milliers pour les humains).
Le nombre de gènes qu’une cellule de synthèse aura besoin de gérer elle-même, est un sujet qui porte à débat. Schwille et d’autres voudraient garder ce nombre aux alentours de quelques dizaines seulement. Cependant, d’autres chercheurs, comme Adamala, pensent que les cellules synthétiques ont besoin de 200 à 300 gènes.
Le biologiste synthétique John Glass et ses collègues du J. Craig Venter Institute (JCVI) de La Jolla, en Californie (USA), ont prélevé l’un des génomes microbiens les plus petits de la planète, celui de la bactérie Mycoplasma mycoides, et en ont systématiquement perturbé les gènes afin d’identifier ceux qui lui étaient essentiels. Une fois qu’ils ont eu cette information, ils ont assemblé chimiquement un génome minimal en laboratoire : ce génome synthétisé contenait 473 gènes (soit environ la moitié de ce qui se trouvait dans l’organisme d’origine), et il a été transplanté dans une espèce bactérienne apparentée, Mycoplasma capricolum.
En 2016, l’équipe de chercheurs a démontré que ce génome de synthèse minimal pouvait « créer » un organisme vivant délibérément, bien que sa croissance soit lente. Glass pense qu’il sera très difficile de réduire ce nombre (de gènes) encore davantage : « enlevez tout gène, et cela tue les cellules, ou ralentit leur croissance à un niveau proche de zéro », explique-t-il.
Avec ses collègues de JCVI, il est en train de compiler une liste de « tâches cellulaires » basée sur la dernière version de leur création, nommée JCVI-syn3.0a, qui pourrait servir de modèle pour la liste de tâches minimale d’une cellule à une plus grande échelle. Malheureusement, pour environ 100 de ces gènes, les chercheurs n’arrivent actuellement pas à identifier leur rôle, et ce qui les rends essentiels.
Lors d’une prochaine étape de la recherche, Glass et Adamala tenteront d’installer le génome de JCVI-syn3.0a dans un liposome synthétique contenant les mécanismes nécessaires à la conversion de l’ADN en protéine, afin de déterminer s’il peut survivre, ou non. Dans ce cas précis, le logiciel et le matériel de la cellule seraient synthétiques dès le départ.
Le but des chercheurs est de déterminer si cette cellule synthétique pourrait se développer et se diviser. Cependant, selon de nombreux scientifiques à travers le monde, afin qu’une cellule synthétique représente réellement le monde du vivant, il faudrait que cette dernière puisse également évoluer et s’adapter à son environnement. Bien entendu, il s’agit là également de l’un des objectifs des chercheurs. « Pour qu’une cellule soit vivante, elle doit développer de nouvelles fonctionnalités », explique Schwille.
L’équipe de Glass au JCVI a fait des expériences d’évolution adaptative en laboratoire avec JCVI-syn3.0a, en sélectionnant des organismes qui se développent plus rapidement dans un mélange riche en nutriments : jusqu’à présent, et ce après environ 400 divisions, lui et son équipe ont obtenu des cellules qui se développent environ 15% plus rapidement que l’organisme d’origine. De plus, les chercheurs ont constaté une poignée de changements dans la séquence des gènes. Cependant, il n’y a encore aucune preuve que le microbe développe de nouvelles fonctions cellulaires ou qu’il améliore sa forme physique.
Erb affirme que le seul moyen de les rendre réellement intéressantes, consiste à déterminer comment ajouter ce facteur de l’évolution aux cellules synthétiques. « En tant qu’ingénieurs, nous ne pouvons pas construire une cellule synthétique parfaite. Nous devons construire un système d’auto-correction qui s’améliore au fur et à mesure », dit-il.
En effet, les cellules synthétiques pourraient permettre de mieux comprendre la vie sur d’autres planètes, par exemple. Et les bioréacteurs synthétiques, sous le contrôle total des chercheurs, pourraient offrir de nouvelles solutions pour le traitement du cancer, la lutte contre la résistance aux antibiotiques ou encore le nettoyage des sites toxiques sur la planète. Les biologistes synthétiques prévoient de continuer à explorer les frontières de la vie.