Tandis que la recherche contre le cancer bat son plein et que plusieurs avancées cruciales ont été effectuées au cours des dernières années, les scientifiques tentent toujours de comprendre les mécanismes à l’origine de la résistance acquise des tumeurs à certaines thérapies, et les raisons des rechutes après un premier succès. Une équipe de chercheurs de l’université de San Francisco a en partie trouvé la réponse à ces questions, en identifiant la protéine spécifique responsable de la survie des cellules cancéreuses dans le cancer du poumon.
Certains cancers du poumon sont caractérisés par la mutation d’une protéine appelée EGFR. Normalement, EGFR agit en tant qu’interrupteur « marche/arrêt » dans un circuit moléculaire complexe qui indique à la cellule quand il convient de se développer et de se diviser, et quand il convient d’arrêter. Bien que le circuit sache généralement quand s’éteindre, les formes mutantes d’EGFR trouvées dans le cancer du poumon sont bloquées dans la position « marche ».
Cela conduit à une prolifération cellulaire anormale et transforme un tissu sain en cancer. Bien que les scientifiques aient mis au point des médicaments sur mesure ciblant l’EGFR mutant et activant le mécanisme d’autodestruction de la tumeur, ces effets curatifs perdurent rarement.
L’échec des thérapies anticancéreuses de précision
Même après trois générations successives de thérapies de précision de plus en plus puissantes, qui ciblent spécifiquement la protéine mutante, les résultats sont toujours les mêmes : jusqu’à 18 mois de rémission suivie d’une rechute. Et lorsque la tumeur réapparaît, elle résiste aux médicaments et est plus agressive que jamais.
« La médecine de précision fait la promesse de permettre aux médecins de traiter les patients avec des médicaments qui ciblent la forme unique d’un cancer. Mais malgré tout le battage médiatique, la médecine de précision n’est pas souvent à la hauteur de son potentiel. C’est une triste réalité clinique qui doit être résolue » explique Sourav Bandyopadhyay, professeur de bioingénierie et de sciences thérapeutiques à l’UCSF, et auteur principal de la nouvelle étude.
Bandyopadhyay indique que la raison pour laquelle un fossé sépare la promesse d’une thérapie de précision et son efficacité réelle, réside dans le fait que les tumeurs sont intelligentes. Elles sont en mesure de réorganiser leurs circuits internes et d’élaborer de nouvelles stratégies pour promouvoir leur propre survie, même après avoir initialement subi le choc d’une thérapie ciblée.
Sur le même sujet : Cancer : détrôner la chimiothérapie grâce au suicide cellulaire forcé
Les chercheurs ont montré que ces médicaments continuaient d’inhiber l’activité de l’EGFR une fois que les tumeurs devenaient résistantes, mais l’auto-recâblage signifie que la tumeur ne dépend plus de la protéine mutante pour sa survie. Bandyopadhyay a donc voulu comprendre ce mécanisme sous-jacent.
Protéine Aurora, le « talon d’Achille » du cancer
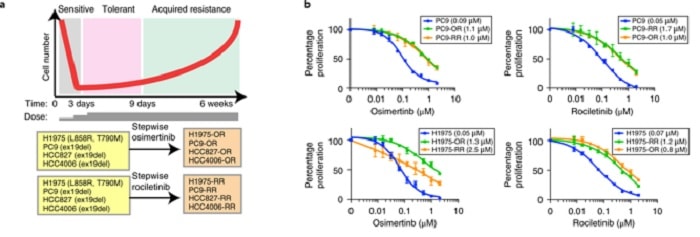
Pour identifier les facteurs de résistance aux médicaments, les chercheurs ont pris plusieurs lignées de cellules cancéreuses avec l’EGFR mutée et les ont traitées in vitro avec de l’osimertinib ou du rociletinib, médicaments de troisième génération ciblant la protéine mutante. L’osimertinib est approuvé par la FDA pour le traitement du cancer du poumon non à petites cellules muté avec l’EGFR.
Bien que les cellules cancéreuses aient semblé mourir après l’administration des médicaments, elles sont revenues six semaines plus tard, résistantes aux deux. Une fois que les cellules cancéreuses ont cessé de répondre aux médicaments ciblant l’EGFR, les chercheurs ont testé 94 médicaments supplémentaires afin de déterminer s’il en existait un qui pourrait inverser la résistance acquise.
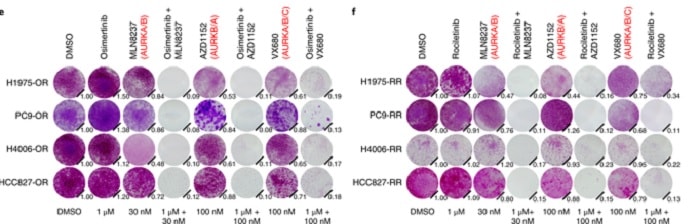
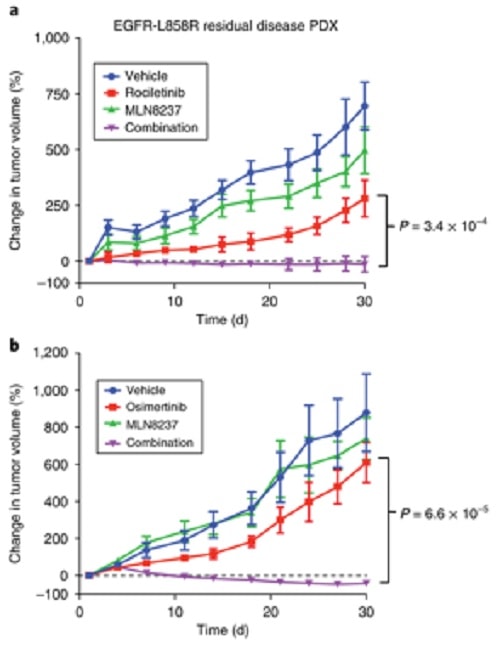
Ils ont découvert que les médicaments ciblant une protéine appelée Aurora Kinase A, associés à l’osimertinib ou au rociletinib, tuaient les cellules cancéreuses une fois pour toutes. Des résultats similaires ont été observés lorsque les chercheurs ont transplanté des tumeurs résistantes aux médicaments provenant de patients atteints d’un cancer du poumon, chez des souris vivantes.
Si les tumeurs ont continué à se développer lorsque les souris ont été traitées avec des médicaments EGFR seuls, l’approche à deux volets dans laquelle les deux protéines ont été ciblées simultanément, a provoqué le rétrécissement des tumeurs sans aucune toxicité observée pour les souris. Les résultats ont été publiés dans la revue Nature Medicine.
« La kinase Aurora n’a jamais été associée à la pharmacorésistance dans le cancer. C’est une voie fondamentalement nouvelle pour l’émergence de la résistance thérapeutique » explique Bandyopadhyay, également membre du centre de traitement du cancer de la famille Helen Diller de l’UCSF.
Aurora : elle permet aux cellules cancéreuses d’échapper à l’apoptose
Les chercheurs ont découvert qu’Aurora ne stimulait pas la croissance de la tumeur. C’est pourquoi un traitement ciblant uniquement Aurora n’a pas réussi à contrecarrer les progrès du cancer. Ce que fournit Aurora est un moyen pour les tumeurs malignes d’échapper à la mort.
L’osimertinib et le rociletinib agissent en désactivant l’EGFR mutant. Cela ralentit non seulement la croissance du cancer, mais déclenche également son circuit d’autodestruction, provoquant le dépérissement et la mort des tumeurs. C’est-à-dire jusqu’à ce que la tumeur se revascularise et active Aurora.
Aurora sert de trappe d’évacuation au cancer. Agissant indépendamment de l’EGFR, Aurora réduit au silence les circuits de suicide de la cellule (apoptose), indépendamment de ce que l’EGFR demande à ces circuits de faire, assurant ainsi la survie du cancer. En ciblant Aurora et l’EGFR mutant en tandem, les chercheurs ont efficacement scellé le destin du cancer en fermant hermétiquement son unique échappatoire.
Une stratégie thérapeutique combinée révolutionnaire
Les chercheurs ont non seulement découvert une nouvelle façon de cibler les tumeurs résistantes aux médicaments, mais ils ont également identifié un biomarqueur qui pourrait indiquer aux cliniciens si le cancer du poumon qu’ils traitent serait susceptible de bénéficier de thérapies combinées ciblant à la fois l’EGFR et Aurora.
Ils ont découvert des taux élevés d’une protéine appelée TPX2 dans des biopsies de cancers du poumon résistant aux médicaments à un stade avancé, prélevés chez plusieurs patients. Ils suggèrent que TPX2, qui est connue pour activer l’Aurora kinase, peut aider les cliniciens à identifier le moment où la tumeur d’un patient succombera à des thérapies combinées ciblées.


La prochaine étape, explique Bandyopadhyay, consistera à faire en sorte que leur approche en deux volets, et le biomarqueur TPX2, soient approuvés pour les essais cliniques.
« Alors que de plus en plus de patients prennent des inhibiteurs de l’EGFR de troisième génération, nos travaux définissent un nouveau mécanisme de résistance qui semble se manifester chez la majorité des patients, et qui peut être ciblé à l’aide des inhibiteurs existants de l’Aurora kinase. Nous espérons que ce travail redynamisera l’intérêt pharmaceutique dans les inhibiteurs du cycle cellulaire, tels que les inhibiteurs de l’Aurora kinase ».
« Nous pensons que cette classe de molécules possède un pouvoir incroyable lorsqu’elle est associée à d’autres traitements ciblés, ce qui n’a jamais été testé auparavant. Nous espérons que nos résultats catalyseront le lancement de nouveaux essais, pour que les patients atteints d’EGFR mutant puissent bénéficier des avantages de notre approche combinée » conclut-il.