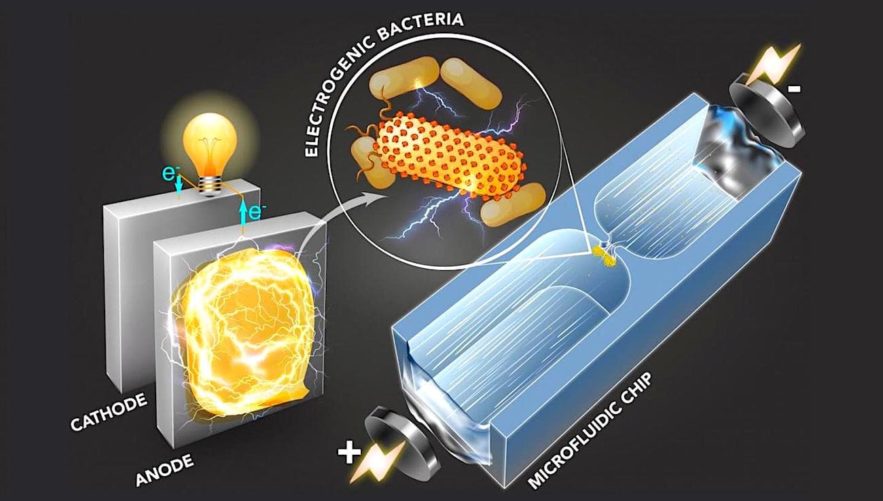
Vivre ou survivre dans des conditions extrêmes nécessite des adaptations, et ces dernières sont souvent très créatives dans la nature. Cela est par exemple le cas de certaines espèces de bactéries présentes dans des environnements dépourvus d’oxygène : elles doivent donc trouver un moyen de respirer sans cet élément vital. Ces véritables « dures à cuire » se trouvent dans les mines, au fond des lacs voire même dans l’intestin, et elles ont développé une forme unique de respiration : elle consiste à excréter et émettre des électrons. En d’autres termes, il s’agit de microbes capables de produire de l’électricité.
Depuis des années, les scientifiques et les ingénieurs étudient des moyens d’utiliser ces bactéries, en grand nombre, pour faire fonctionner des piles à combustible et, entre autres, purifier les eaux des égouts par exemple. Mais cerner les propriétés électriques d’un microbe représentait jusqu’à aujourd’hui un véritable défi : les cellules sont beaucoup plus petites que celles des mammifères, et extrêmement difficiles à cultiver en laboratoire.
Des ingénieurs du MIT ont mis au point une technique microfluidique capable de traiter rapidement de petits échantillons de bactéries et d’évaluer une propriété spécifique, étroitement liée à la capacité de ces dernières à produire de l’électricité. Selon eux, cette propriété, connue sous le nom de polarisabilité (dans un contexte plus standard, la polarisabilité désigne un phénomène causé par le moment des charges électriques d’un atome), peut être utilisée pour évaluer l’activité électrochimique d’une bactérie de manière plus fiable et plus efficace qu’avec les techniques actuelles.
« L’idée est de sélectionner les candidats les plus efficaces pour accomplir les tâches utiles que nous souhaitons », explique Qianru Wang, postdoctorante au Département de génie mécanique du MIT.
« Des travaux récents suggèrent qu’il pourrait y avoir une gamme beaucoup plus large de bactéries ayant des propriétés productrices d’électricité », ajoute Cullen Buie, professeur agrégé de génie mécanique au MIT. « Ainsi, posséder un outil permettant de sonder ces organismes pourrait être beaucoup plus important que prévu. Car il n’existe pas seulement qu’une petite poignée de microbes différents capables de le faire ». Les résultats de l’étude ont été publiés vendredi dans la revue Science Advances.
Les bactéries qui produisent de l’électricité le font en générant des électrons dans leurs cellules, puis en les transférant à travers leurs membranes cellulaires via de minuscules canaux formés de protéines de surface, selon un processus appelé transfert d’électrons extracellulaire, connu surtout sous le nom de « transfert d’énergie entre molécules fluorescentes » (EET).
Les techniques existantes servant à sonder l’activité électrochimique des bactéries impliquent la culture de grands lots de cellules et la mesure de l’activité des protéines EET — un processus minutieux et fastidieux. D’autres techniques nécessitent la rupture d’une cellule afin de purifier et de sonder les protéines. Buie recherchait donc une méthode plus rapide et moins destructive pour évaluer la fonction électrique des bactéries.
Depuis maintenant 10 ans, son groupe de recherche fabrique des puces microfluidiques sur lesquelles sont gravés de petits canaux, à travers lesquels les chercheurs font passer des petits échantillons de bactéries. Chaque canal se réduit au milieu pour former une configuration en sablier. Lorsqu’une tension électrique est appliquée sur un canal, la section plus étroite — environ 100 fois plus étroite que le reste du canal — exerce une pression sur le champ électrique, le rendant ainsi 100 fois plus puissant que le champ environnant.
Le gradient du champ électrique crée un phénomène appelé diélectrophorèse. Il s’agit d’une force qui pousse la cellule contre son mouvement induit par le champ électrique. De ce fait, la diélectrophorèse peut repousser une particule ou la bloquer, à différentes tensions appliquées, en fonction des propriétés de surface de la particule en question.
Des chercheurs, dont Buie, ont exploité la diélectrophorèse pour trier rapidement les bactéries en fonction de propriétés générales, telles que la taille et l’espèce. Buie s’est demandé cette fois-ci si cette technique pourrait extraire l’activité électrochimique de la bactérie (une propriété beaucoup plus subtile).
« En gros, les gens utilisaient la diélectrophorèse pour séparer des bactéries aussi différentes que, par exemple, une grenouille d’un oiseau, alors que nous essayons ici de distinguer les frères et soeurs au sein d’une famille de grenouilles – donc de plus petites différences », explique Wang.
Dans leur nouvelle étude, les chercheurs ont utilisé leur configuration microfluidique pour comparer différentes souches de bactéries, chacune ayant une activité électrochimique différente et connue. La sélection de souches de bactéries incluait un type « sauvage » (ou naturelle), qui produit activement de l’électricité dans des piles à combustible microbiennes, ainsi que plusieurs souches de bactéries génétiquement modifiées par les chercheurs.
L’équipe a cherché à savoir s’il existait une corrélation entre les capacités électriques d’une bactérie, et son comportement dans un dispositif microfluidique soumis à une force diélectrophorétique.
Pour cela, les chercheurs ont fait passer de très petits échantillons de chaque souche bactérienne à travers le canal microfluidique en forme de sablier, puis ont progressivement augmenté la tension électrique appliquée à ce dernier. L’augmentation était d’un volt toutes les secondes, de 0 à 80 volts.
Grâce à une technique d’imagerie connue sous le nom de « vélocimétrie par images de particules », ils ont observé que le champ électrique résultant propulsait les cellules bactériennes à travers le canal, jusqu’à ce qu’elles atteignent la section plus étroite, où le champ électrique, beaucoup plus puissant, repousse les bactéries via une diélectrophorèse pour les piéger sur place.
Certaines bactéries ont été piégées à des tensions appliquées inférieures et d’autres à des tensions supérieures. Wang a pris note de la « tension de piégeage » de chaque cellule bactérienne, a mesuré leur taille, puis a utilisé une simulation informatique pour calculer la polarisabilité d’une cellule — la facilité avec laquelle une cellule peut former des dipôles électriques en réponse à un champ électrique externe.
D’après ses calculs, Wang a découvert que les bactéries plus actives électrochimiquement avaient tendance à avoir une polarisabilité plus élevée. Elle a observé cette corrélation parmi toutes les espèces de bactéries testées par le groupe.
« Nous disposons des preuves nécessaires pour montrer qu’il existe une forte corrélation entre la polarisabilité et l’activité électrochimique », a déclaré Wang. « En fait, nous pourrions utiliser la polarisabilité en tant qu’intermédiaire pour sélectionner des microorganismes ayant une activité électrochimique élevée ».
Wang explique que, du moins pour les souches qu’ils ont mesurées, les chercheurs peuvent évaluer leur production d’électricité en mesurant leur polarisabilité. Et cela est maintenant possible grâce à leur technique microfluidique. D’ailleurs, la technique permet de le faire facilement, efficacement et de manière non destructive.
Les collaborateurs de l’équipe utilisent actuellement cette méthode pour tester de nouvelles souches de bactéries, récemment identifiées comme productrices potentielles d’électricité.
« Si la même tendance de corrélation s’applique à ces nouvelles souches, cette technique pourrait avoir une application plus large, dans la production d’énergie propre, la biorestauration et la production de biocarburants », explique Wang.
Cette recherche a été financée en partie par la National Science Foundation et l’Institute for Collaborative Biotechnologies.