Au cours des dernières années, la lutte contre le vieillissement cellulaire est devenu un sujet actif de recherche en biologie. L’un des axes de recherche se concentre sur les télomères des chromosomes, c’est-à-dire les extrémités chromosomiques, qui se raccourcissent un peu plus à chaque division cellulaire. Cependant, jusqu’à maintenant, la manipulation des télomères et de l’enzyme associée, la télomérase, nécessitait des modifications génétiques in situ. Récemment, une équipe de biologistes a montré qu’il était possible de rallonger les télomères, et donc la durée de vie, sans altération génétique, chez des souris. Les résultats ont produit des souris avec une plus longue durée de vie, une meilleure santé et un métabolisme plus efficace.
Une découverte fortuite effectuée il y a dix ans a conduit les chercheurs du Centre national espagnol de recherche sur le cancer (CNIO) à créer les premières souris avec des télomères beaucoup plus longs que la normale chez leur espèce. Compte tenu de la relation entre les télomères et le vieillissement — les télomères raccourcissent durant la vie, les organismes plus âgés ont donc des télomères plus courts —, les biologistes ont mis au point des souris dont 100% de leurs cellules avaient des télomères hyper-longs.
Les résultats ont été publiés dans la revue Nature Communications et ne montrent que des conséquences positives : les animaux aux télomères hyper-longs vivent plus longtemps et en meilleure santé, sans cancer ni obésité. Le point clé de l’étude, pour les auteurs, est le fait que la longévité a été considérablement augmentée pour la première fois sans aucune modification génétique.
« Cette découverte conforte l’idée que, lorsqu’il s’agit de déterminer la longévité, les gènes ne sont pas la seule chose à prendre en compte » indique Maria Blasco, responsable du groupe CNIO Telomeres and Telomerase. « Il y a une marge pour prolonger la vie sans altérer les gènes ».
Longueur des télomères et modifications génétiques
Les télomères forment l’extrémité des chromosomes, dans le noyau de chaque cellule du corps. Leur fonction est de protéger l’intégrité de l’information génétique portée par l’ADN. Chaque fois que les cellules se divisent, les télomères se raccourcissent. L’une des principales caractéristiques du vieillissement est donc l’accumulation de télomères courts dans les cellules.
« Le raccourcissement des télomères est considéré comme l’une des principales causes du vieillissement, car les télomères courts provoquent le vieillissement de l’organisme et réduisent sa longévité » expliquent les auteurs. Le groupe CNIO Telomeres and Telomerase a déjà montré dans diverses études que le fait d’éviter le raccourcissement des télomères par l’activation de l’enzyme allongeant ces derniers, la télomérase, augmente la longévité sans aucun effet secondaire.
Cependant, jusqu’à présent, toutes les interventions sur la longueur des télomères reposaient sur la modification de l’expression des gènes. En fait, il y a quelques années, le groupe CNIO a mis au point une thérapie génique qui favorise la synthèse de la télomérase. Les chercheurs ont ainsi obtenu des souris qui vivent 24% plus longtemps sans développer de cancer et d’autres maladies associées à l’âge.
Télomères, télomérase et cellules souches pluripotentes
La nouveauté est que, dans cette étude, il n’y a pas eu d’altération génétique chez les souris nées avec des télomères hyper-longs. En 2009, des chercheurs ont travaillé avec des cellules IPS — des cellules souches pluripotentes — et ont observé qu’après un certain nombre de divisions sur des plaques de culture, ces cellules ont acquis des télomères deux fois plus longs que la normale. Intrigués, ils ont confirmé qu’il en était de même dans les cellules embryonnaires normales — également pluripotentes — conservées en culture après avoir été retirées du blastocyste.
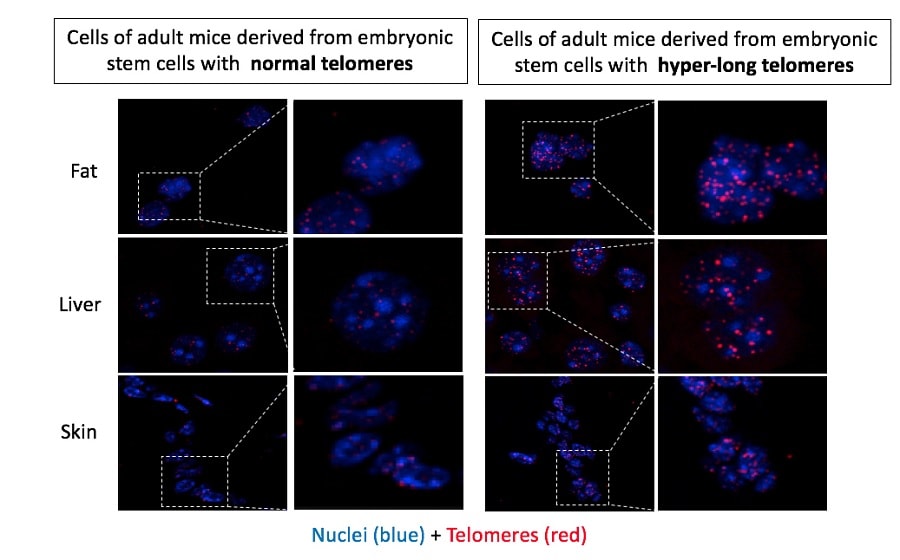
En faisant des recherches sur le phénomène, l’équipe de Blasco a découvert qu’au cours de la phase de pluripotence, certaines marques biochimiques (marques épigénétiques) sur la chromatine télomérique facilitent leur allongement par la télomérase. Pour cette raison, les télomères des cellules pluripotentes en culture ont été étendus à deux fois la longueur normale. La question était de savoir si les cellules embryonnaires avec des télomères hyper-longs pouvaient produire des souris viables ?
Sur le même sujet : Des scientifiques inversent le processus de vieillissement dans les cellules souches de cerveaux de rats
Durée de vie plus longue, meilleure santé et métabolisme plus efficace
Il y a quelques années, le groupe a démontré que c’était possible. Cependant, ces premiers animaux étaient chimériques, c’est-à-dire qu’une partie seulement de leurs cellules — entre 30% et 70% — provenait de cellules embryonnaires dotées de télomères hyper-longs. Leur bonne santé pouvait être attribuée au bon fonctionnement du reste des cellules, avec des télomères normaux. Dans l’étude qui vient d’être publiée, les auteurs sont parvenus à obtenir des télomères hyper-longs dans 100% des cellules des souris.
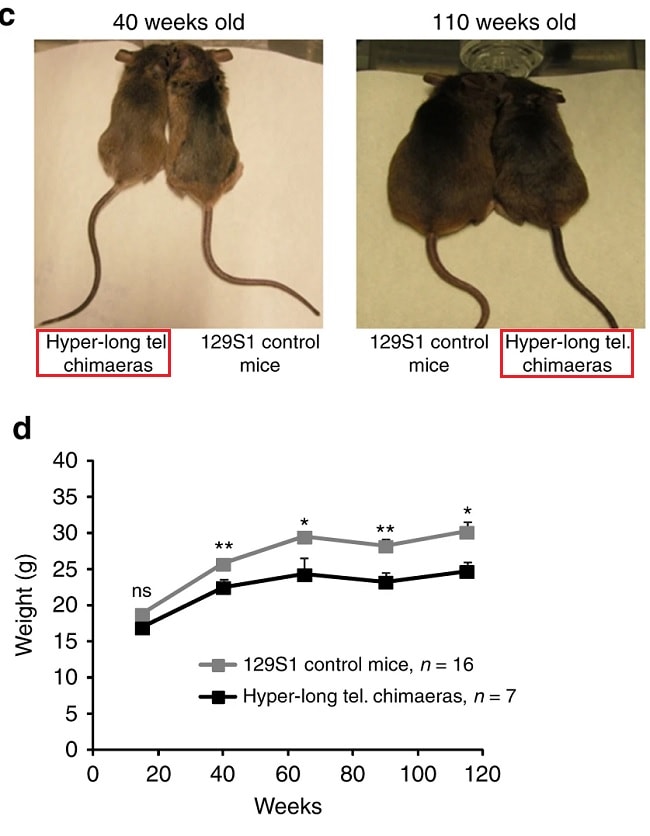
« Ces souris ont moins de cancers et vivent plus longtemps. Un fait important est aussi qu’elles sont plus minces que la normale, car elles accumulent moins de graisse. Elles présentent également un vieillissement métabolique plus faible, des taux de cholestérol et de LDL inférieurs et une tolérance accrue à l’insuline et au glucose. Les dommages occasionnés par la vieillesse à leur ADN sont plus faibles et leurs mitochondries fonctionnent mieux » expliquent les auteurs.
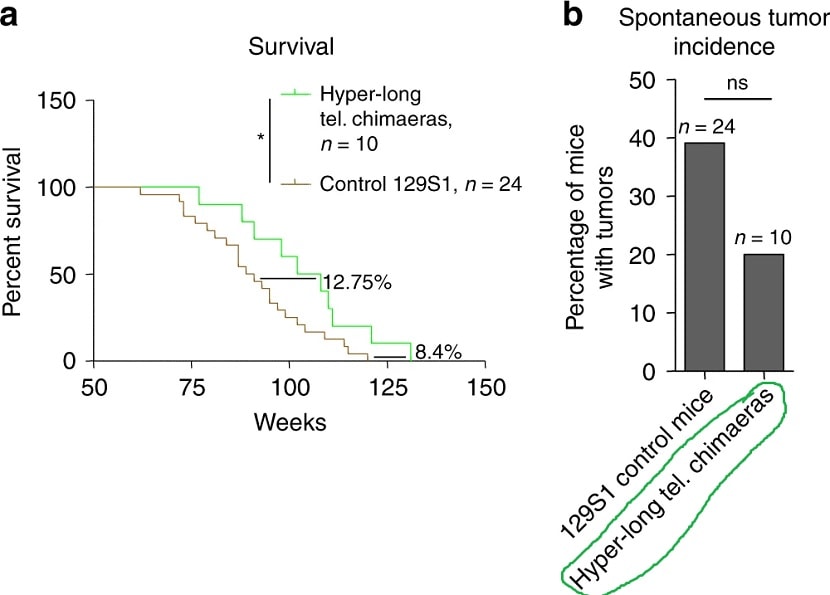
Plus spécifiquement, la longévité moyenne des souris avec des télomères hyper-longs est 13% plus élevée. Les altérations métaboliques observées sont également pertinentes, car c’est la première fois qu’il existe une relation claire entre la longueur des télomères et le métabolisme. La voie génétique du métabolisme de l’insuline et du glucose est identifiée comme l’une des plus importantes en rapport avec le vieillissement.
Retarder le vieillissement sans manipulation génétique
Cette découverte ouvre la voie à une prolongation de la longévité sans modifier les gènes de l’organisme. Les modifications biochimiques de la chromatine télomérique qui facilitent l’allongement des télomères dans la phase de pluripotence sont épigénétiques. En d’autres termes, elles agissent comme une annotation chimique qui modifie le travail des gènes, mais ne modifient pas leur structure.
« Prolonger le temps pendant lequel les cellules embryonnaires restent pluripotentes pour générer des souris avec des télomères plus longs, protégées du cancer et de l’obésité et avec une longévité accrue, a été suffisant pour que les souris aient des télomères plus longs et vivent plus longtemps. Nous présentons un nouveau modèle de souris dans lequel le vieillissement a été retardé sans aucune manipulation génétique » concluent les chercheurs.