Suite à un traitement spécifique contre le cancer, appelé thérapie photodynamique, certains patients ont rapporté ressentir des différences dans leur vision nocturne, notamment la capacité à voir plus clairement ou à mieux distinguer des objets dans l’obscurité. La thérapie photodynamique utilise la lumière pour détruire les cellules cancéreuses, et son interaction avec certaines protéines photosensibles serait à l’origine de cet effet secondaire mystérieux.
Dans une récente étude, des chercheurs exposent leur compréhension de ce qui serait la cause de cette modification de la photosensibilité : la rhodopsine, une protéine sensible à la lumière contenue dans la rétine, interagit avec un composé photosensible appelé chlorine e6, une composante cruciale de ce type de traitement du cancer.
Le travail s’appuie sur ce que les scientifiques savent déjà sur le composé organique rétinien, qui se situe dans l’œil et n’est généralement pas sensible à la lumière infrarouge. Les résultats ont été publiés dans le Journal of Physical Chemistry Letters.
Une interaction entre la rhodopsine et la chlorine e6
La lumière visible provoque la séparation de la rhodopsine de la rétine. Cela est alors converti en signaux électriques, que notre cerveau interprète pour constituer une image. Bien que peu de lumière visible soit disponible durant la nuit, il s’avère que ce mécanisme peut également être déclenché avec une autre combinaison de lumière et de réaction chimique : sous la lumière infrarouge et avec une injection de chlorine e6, la rétine subit les mêmes réactions que sous la lumière visible.
« Cela explique l’augmentation de l’acuité visuelle nocturne », a expliqué au CNRS le chimiste Antonio Monari, de l’Université de Lorraine en France. « Cependant, nous ne savions pas précisément comment la rhodopsine et son groupe rétinien actif interagissaient avec la chlorine. C’est ce mécanisme que nous avons maintenant réussi à élucider via la simulation moléculaire ».
Modéliser les mouvements d’atomes individuels pour comprendre le mécanisme impliqué
Parallèlement à certains calculs chimiques, l’équipe a utilisé une simulation moléculaire pour modéliser les mouvements d’atomes individuels (en termes d’attraction et de répulsion respective), ainsi que la rupture ou la création de liaisons chimiques.
La simulation, qui fait l’objet de millions de calculs, a duré plusieurs mois avant de pouvoir modéliser avec précision la réaction chimique causée par le rayonnement infrarouge. Dans la réalité, cette réaction se produirait en quelques nanosecondes.
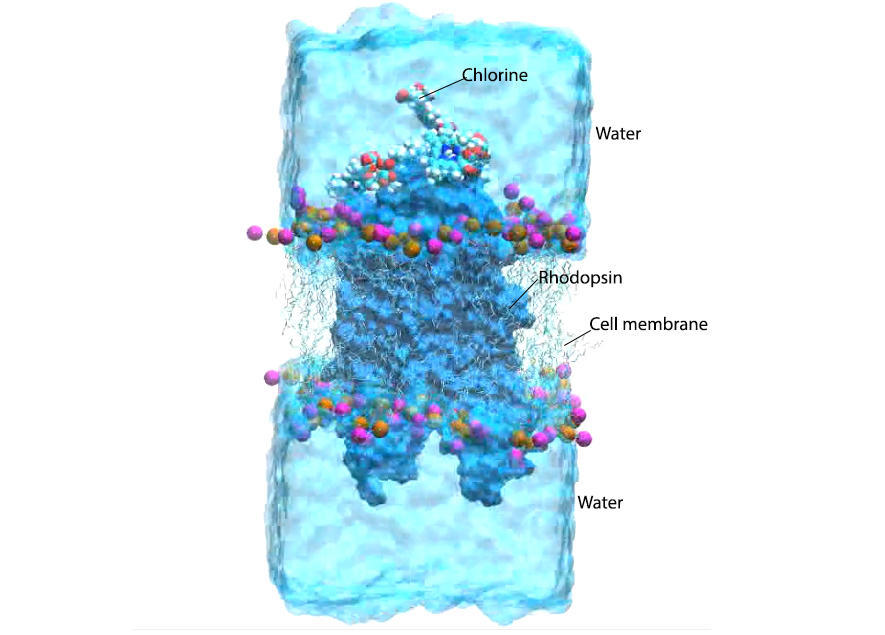
« Pour notre simulation, nous avons placé une protéine de rhodopsine virtuelle insérée dans sa membrane lipidique en contact avec plusieurs molécules de chlorine e6 et de l’eau, impliquant plusieurs dizaines de milliers d’atomes », a expliqué Monari.
Comme la chlorine e6 absorbe le rayonnement infrarouge, elle interagit avec l’oxygène dans le tissu oculaire, le transformant en oxygène singulet (état métastable excité) très réactif et détruisant les cellules cancéreuses. La simulation moléculaire montre que l’oxygène singulet peut également réagir avec la rétine et temporairement améliorer la vision nocturne.
Sur le même sujet : Une nouvelle technologie permettant de doter les yeux d’une vision nocturne
Soigner certains types de cécité ou de sensibilité excessive à la lumière
Maintenant que les chercheurs connaissent la chimie qui sous-tend cet effet secondaire étrange, ils pourraient être en mesure de limiter les risques que cela se produise chez les patients soumis à une thérapie photodynamique, dont certains ont rapporté avoir vu des silhouettes et des contours autrement invisibles dans l’obscurité.
Cette réaction chimique pourrait, à terme, également être exploitée pour aider à traiter certains types de cécité ou de sensibilité excessive à la lumière. Pour le moment cependant, exploiter ce phénomène encore peu compris pour offrir une vision nocturne surhumaine est plus que contre-indiqué…
« La simulation moléculaire est déjà utilisée pour éclairer les mécanismes fondamentaux — par exemple, pourquoi certaines lésions de l’ADN sont mieux réparées que d’autres ? Elle permet également la sélection de molécules thérapeutiques potentielles, en mimant leur interaction avec une cible choisie », a déclaré Monari.



