Après plus de 20 ans de recherche, nous assistons aujourd’hui à une percée dans le domaine des thérapies basées sur les petits ARN interférents (dits pARNi, ou siRNA, de l’anglais small interfering RNA). En 2018, le premier médicament siRNA, nommé Onpattro, a été mis sur le marché, suivi de l’approbation de Givlaari en 2019. À présent, de nombreux autres essais cliniques sont en cours.
Les thérapies siRNA détiennent le potentiel de traiter un vaste éventail de maladies, allant du cancer aux troubles immunologiques. Avec un système d’administration approprié de la thérapie, cette dernière pourrait être dirigée vers la régulation négative d’un gène cible spécifique.
Les deux médicaments siRNA approuvés (Onpattro et Givlaari) ne peuvent cependant atteindre que le foie. D’autres organes qui peuvent être traités par administration locorégionale, comme le poumon, sont également, en principe, de bonnes cibles pour les thérapies siRNA.
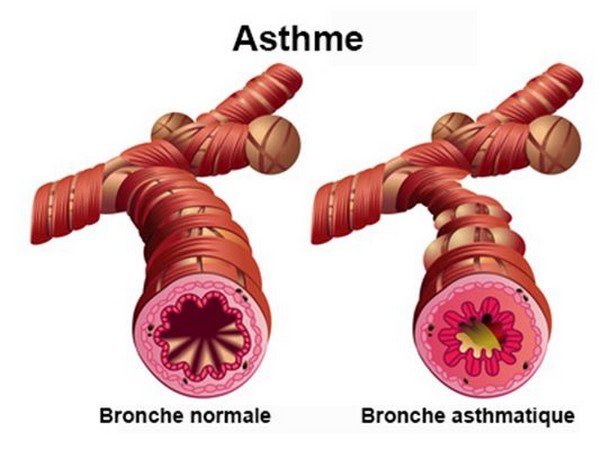
De ce point de vue, les médicaments à base de siRNA pourraient non seulement agir comme des alliés dans la lutte contre la pandémie actuelle de COVID-19, mais aussi contre d’autres maladies pulmonaires graves telles que l’asthme. Malgré les grandes avancées du traitement de l’asthme, cette maladie représente toujours un besoin médical non satisfait chez environ 5 à 10% des patients. De plus, la plupart des médicaments disponibles agissent de manière symptomatique plutôt que causale.
Dans un article récent, Domizia Baldassi et Tobias Keil, étudiants diplômés du groupe de recherche du professeur Olivia Merkel à l’Université de Munich en Allemagne, discutent des progrès du groupe vers le développement d’un nanosupport capable de fournir le siARN dans les cellules T du poumon.
À noter que les cellules T (ou lymphocytes T) sont une catégorie de leucocytes qui jouent un grand rôle dans la réponse immunitaire secondaire. Ils sont responsables de l’immunité cellulaire : les cellules infectées par un virus (par exemple), ou les cellules cancéreuses reconnues comme étrangères à l’organisme (c’est-à-dire distinctes des cellules que les lymphocytes T ont appris à tolérer lors de leur maturation), sont détruites par un mécanisme complexe.
Développer un nanosupport pour fournir le siARN dans les cellules T du poumon
L’objectif de délivrer le siARN dans les cellules T est la régulation négative de GATA-3, le facteur de transcription des cellules T helper 2 (TH2), surexprimé chez les patients asthmatiques et reconnu comme étant un facteur clé dans la cascade inflammatoire asthmatique. En se basant sur leur observation, selon laquelle le récepteur de la transferrine (molécule qui transporte le fer) est surexprimé dans les cellules T activées, les chercheurs ont souhaité trouver un « outil semblable à un virus pour cibler les cellules TH2 activées spécifiquement et efficacement d’une manière médiée par les récepteurs ».
Et ils ont réussi à atteindre cet objectif en créant une forme de transferrine et de polyéthylénimine de bas poids moléculaire (dit Tf-PEI) : d’une part, ils ont utilisé un polymère cationique bien connu pour interagir électrostatiquement avec le siARN chargé négativement, et le protéger de la dégradation pendant le voyage à travers les voies respiratoires. Et d’autre part, la transferrine a servi de fragment de ciblage pour effectuer une livraison ciblée spécifique de siRNA, mais uniquement aux cellules T activées. Puis, les chercheurs ont mélangé le Tf-PEI avec un second composé de mélittine et de PEI (Mel-Î.-P.-É.). À savoir que la mélittine est un agent membranolytique bien connu, provenant du venin d’abeille, qui a été chimiquement modifié pour réagir de manière dépendante du pH.
Vous aimerez également : Un médicament contre l’asthme inverse totalement des symptômes neurodégénératifs chez la souris
Les chercheurs ont exploité la caractéristique lytique intrinsèque du peptide pour améliorer la libération du siRNA dans le cytosol, atteignant des niveaux aussi élevés que 70% (en ex vivo). Mais d’autres étapes telles que la validation de ces résultats in vivo sur un modèle de souris asthmatique sont nécessaires, ainsi que la suggestion d’autres matériaux polymères utilisables.
Mettre en place la bonne voie d’administration
De plus, dans le processus de développement d’un nouveau produit pharmaceutique, il est essentiel de garder à l’esprit la voie d’administration. Par exemple, selon les chercheurs, la pulvérisation est la technique la plus simple pour produire des particules inhalables, pour une administration pulmonaire.
Dans une étude de preuve de concept, ils ont obtenu des nano-microparticules en effectuant un séchage par pulvérisation des polyplex PEI-pDNA avec un agent cryoprotecteur. Puis, après obtenu des résultats prometteurs, leurs études pour parvenir à une formulation en poudre sèche de polyplex à base de siRNA sont en cours.
« En fin de compte, les deux domaines de recherche seront combinés et, espérons-le, déboucheront sur une nouvelle thérapie pour le traitement de l’asthme sévère et non contrôlé, ainsi que de nombreuses autres maladies pulmonaires », ont conclu Baldassi, Keil et Merkel.