L’édition de gènes est sans aucun doute l’une des avancées les plus remarquables de la recherche biomédicale. La technique CRISPR-Cas9 notamment — un ciseau moléculaire qui permet de modifier, d’ajouter ou de supprimer un gène dans une cellule — permet aujourd’hui de traiter un grand nombre d’anomalies génétiques. Des chercheurs américains viennent de franchir une nouvelle étape en développant un « kit » d’édition de gènes, qui peut être directement injecté dans l’organisme et agir sur une zone ou un organe spécifique.
Bien que cette technique d’édition génomique soit hautement précise, il n’y avait jusqu’à présent aucun moyen de faire en sorte que le traitement cible un endroit spécifique du corps. Le traitement impliquait de retirer les cellules souches du sang, ou des cellules T du système immunitaire, pour les modifier in vitro (en laboratoire) avant de les réinjecter dans le corps du patient. Un processus long et coûteux.
Une « boîte à outils » livrée à la bonne adresse
C’est en 2012 que les deux chercheuses Emmanuelle Charpentier et Jennifer Doudna ont réussi à mettre au point de véritables ciseaux moléculaires capables de cibler des endroits précis du génome de n’importe quelle cellule. Elles viennent tout juste d’être récompensées par le prix Nobel de Chimie 2020 pour leur découverte. Aujourd’hui, cette technique est utilisée pour traiter les personnes atteintes d’anémie falciforme (ou drépanocytose) ou de certains cancers (myélome multiple et liposarcome).
En s’appuyant sur les travaux de Charpentier et Doudna, une équipe de chercheurs de l’université Tufts, dirigée par Qiaobing Xu, a réussi à mettre au point un moyen d’introduire des outils d’édition de gènes directement dans des régions spécifiques du cerveau, dans les cellules du système immunitaire ou bien dans des tissus ou organes spécifiques. Les modifications génétiques s’effectuent au sein même de l’organisme et non plus dans un laboratoire. Leur méthode a été testée avec succès sur des souris. Elle ouvre ainsi la voie à une nouvelle stratégie de traitement des affections neurologiques, du cancer, des maladies infectieuses et des maladies auto-immunes.
Pour conditionner ce kit d’édition injectable, l’équipe a utilisé des nanoparticules lipidiques, qui peuvent envelopper les enzymes d’édition et les transporter vers les cellules, tissus ou organes cibles. Les molécules lipidiques sont composées d’une longue queue carbonée hydrophobe et d’une tête hydrophile, attirée par un environnement aqueux ; de ce fait, elles s’organisent spatialement en nanoparticules sphériques (des micelles), les têtes tournées vers l’extérieur, les queues orientées vers le centre. Des liants à base d’azote, de soufre ou d’oxygène se trouvent également entre la tête et la queue.
Pour doter ces « moyens de transport » de propriétés sélectives, l’équipe de Xu a modifié la surface des nanoparticules, afin qu’elles puissent éventuellement « adhérer » à certains types de cellules, fusionner avec leurs membranes et libérer les enzymes d’édition de gènes à l’intérieur.
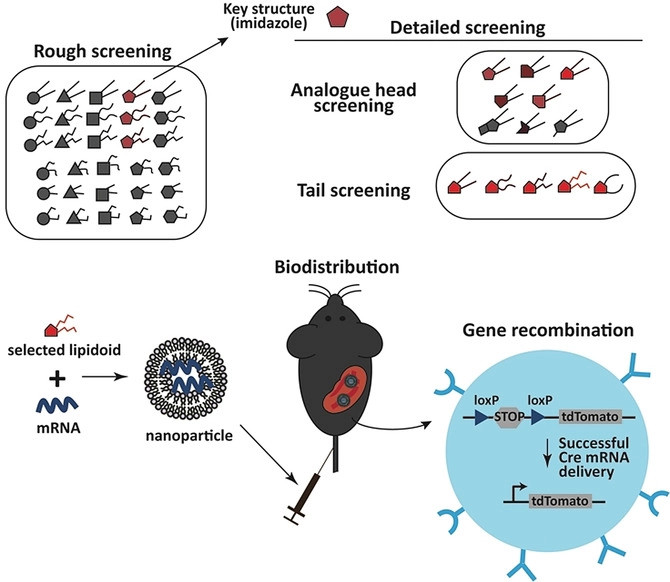
Ceci a nécessité quelques manipulations, à commencer par une sélection, en laboratoire, des meilleurs candidats parmi les têtes, queues et liants lipidiques, pour la formation de nanoparticules. Ceci fait, ces molécules ont été modifiées chimiquement pour optimiser le ciblage des cellules, puis testées sur des souris. « Les méthodes s’appuient sur la chimie combinatoire utilisée par l’industrie pharmaceutique pour concevoir les médicaments », explique Xu ; mais l’approche s’applique ici à la conception des « véhicules de livraison » et non de leur contenu.
Un moyen de renforcer le système immunitaire
La capacité à administrer des médicaments de manière sûre et efficace à travers la barrière hématoencéphalique — la barrière physiologique qui sépare le système nerveux central de la circulation sanguine — et dans le cerveau a longtemps représenté un défi en médecine. Pour aider les particules à traverser cette barrière, Xu et son équipe ont ajouté un neurotransmetteur à la tête de certains lipides.
Dans un premier temps, ils ont réussi à délivrer tout un complexe d’ARN messagers et d’enzymes composant le kit d’édition CRISPR dans des zones ciblées du cerveau d’un animal vivant. Quelques légères modifications au niveau des liants et des queues lipidiques ont permis de créer des nanoparticules capables de livrer directement dans le cerveau de l’animal de l’amphotéricine B (une petite molécule antifongique, utilisée pour le traitement de la méningite) et un fragment d’ADN qui stoppe le gène produisant la protéine tau liée à la maladie d’Alzheimer.
Plus récemment, l’équipe de Xu a mis au point des nanoparticules capables de livrer des outils d’édition de gènes directement dans les cellules T — des lymphocytes qui contribuent à la production d’anticorps et détruisent les cellules infectées par un virus — chez la souris. Ces nanoparticules fusionnent avec les cellules T de la rate ou du foie — où elles se trouvent généralement — pour y déposer le kit d’édition génomique, qui peut alors modifier la composition moléculaire et le comportement des cellules T.
L’approche de Xu pour modifier le génome des cellules T est beaucoup plus ciblée, efficace et plus sûre que les méthodes testées jusqu’à présent, qui impliquaient d’utiliser des virus pour aboutir à ce résultat. La méthode permet non seulement d’entraîner le système immunitaire (comme un vaccin pourrait le faire), mais aussi de le modifier pour qu’il lutte plus efficacement contre la maladie. « En ciblant les cellules T, nous pouvons puiser dans une branche du système immunitaire qui a une énorme polyvalence dans la lutte contre les infections, la protection contre le cancer et la modulation de l’inflammation et de l’auto-immunité », souligne Xu.
Xu et son équipe ont exploré plus en détail le mécanisme via lequel les nanoparticules lipidiques pourraient trouver leur chemin dans le corps, pour atteindre un objectif bien précis. Dans des expériences visant des cellules pulmonaires, ils ont notamment découvert que les nanoparticules captaient des protéines spécifiques dans la circulation sanguine après l’injection. Or, ces protéines ainsi intégrées à la surface des nanoparticules sont devenues le composant majeur qui leur a permis de s’accrocher aux cellules cibles. Une découverte qui pourrait aider à améliorer la conception des futures particules de livraison.
Ces premiers résultats observés chez la souris sont très encourageants, mais Xu a averti que d’autres études et essais cliniques seront nécessaires pour déterminer l’efficacité et la sécurité de la méthode d’administration chez l’Homme.



