Il y a quelques jours, le laboratoire AstraZeneca déclarait que son vaccin anti-COVID-19 pourrait être prêt d’ici la fin de l’année. C’est au tour de Pfizer et BioNTech d’annoncer une bonne nouvelle : le vaccin qu’ils ont élaboré conjointement serait efficace à 90%. Cette efficacité vaccinale a été déterminée lors d’une analyse intermédiaire de l’ultime phase de test clinique du produit.
Lundi 9 novembre, l’alliance pharmaceutique germano-américaine formée par Pfizer et BioNTech a partagé ses premiers résultats, particulièrement prometteurs : actuellement au stade 3 des essais cliniques, leur candidat-vaccin afficherait une efficacité de 90%. Alors que les autorités sanitaires internationales espéraient, au mieux, une efficacité de 50%, le chiffre paraît presque trop élevé pour être vrai…
Le premier vaccin à ARNm pour l’Homme ?
Une chose est sûre, les 90% annoncés par le duo ont provoqué un emballement sans précédent, notamment sur les marchés boursiers. Les actions des entreprises qui auraient le plus à gagner d’un retour rapide à une activité normale (compagnies aériennes, exploitants de centres commerciaux, etc.) ont grimpé en flèche. « Aujourd’hui est un grand jour pour la science et l’humanité », a déclaré le PDG de Pfizer, Albert Bourla.
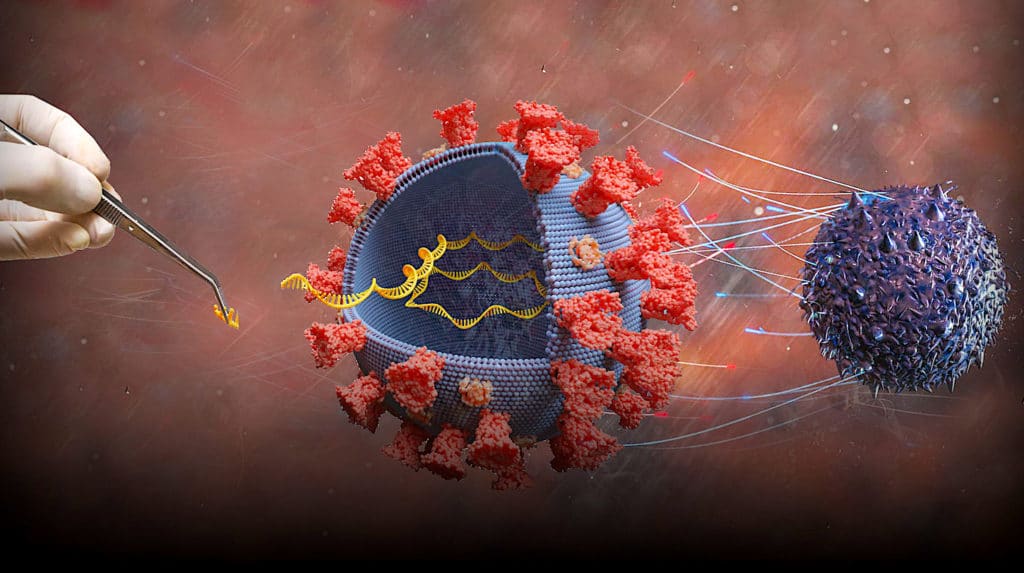
Le produit formulé par les deux sociétés, dénommé BNT162b2, est un vaccin à ARN messager. Ce type de vaccin consiste à inciter les cellules de l’organisme à synthétiser elles-mêmes des molécules virales, qui stimuleront le système immunitaire. Concrètement, un fragment d’ARNm codant pour des protéines se trouvant à la surface du coronavirus est injecté à l’intérieur des cellules musculaires ; il est alors utilisé par les cellules comme « plan d’assemblage » pour produire des protéines, qui seront relâchées ensuite dans l’organisme. Le système immunitaire va réagir à ces antigènes et produire des anticorps qui seront par la suite capables de reconnaître les protéines du SARS-CoV-2.
Bien que ce type de vaccin ait déjà montré des effets prometteurs lors d’essais cliniques, et présente plusieurs avantages par rapport aux autres techniques, aucun vaccin à ARNm n’a à ce jour été approuvé pour une utilisation sur l’Homme. Ce vaccin anti-COVID-19, s’il arrive sur le marché, sera donc le premier du genre.
Le BNT162b2 fait actuellement l’objet d’un essai clinique de phase III mené en double aveugle, dans plus de 120 centres dans le monde. Les deux laboratoires ont annoncé que plus de 43’000 participants avaient été recrutés pour cet essai, dont près de 39’000 avaient déjà reçu une seconde injection du candidat-vaccin (à trois semaines d’intervalle de la première dose). Les 90% d’efficacité correspondent à la protection observée sur un échantillon de ces participants ; après que 94 personnes ont contracté la COVID-19, les scientifiques ont déterminé combien d’entre elles avaient reçu le placebo et combien avaient bénéficié du vaccin.
Les premiers résultats ont dépassé toutes les espérances et ont surpris la plupart des scientifiques, qui ne s’attendaient pas à une efficacité aussi élevée. Après plusieurs semaines de collecte de données de sécurité, Pfizer prévoit maintenant de soumettre le vaccin pour une autorisation d’utilisation d’urgence à la Food and Drug Administration. Si tout se passe comme prévu, les premières doses du vaccin pourraient être administrées au personnel soignant de certains pays d’ici la fin de l’année.
Avant d’obtenir une autorisation de mise sur le marché, les laboratoires devront avoir observé et analysé les effets du vaccin pendant deux mois sur l’ensemble des participants de la phase 3, soit jusqu’à la fin novembre. Le laboratoire Pfizer a cependant précisé qu’il souhaitait poursuivre l’essai jusqu’à ce que 164 cas positifs soient identifiés.
Des résultats partiels, à confirmer par les pairs
La COVID-19 a provoqué à ce jour plus de 1,2 million de décès et près de 51 millions de contaminations. Alors que les taux d’infections battent actuellement de nouveaux records — plus de 20’000 nouveaux cas dans les dernières 24h en France —, que certains services de réanimation commencent à frôler la saturation, le timing est idéal. « C’était une situation dévastatrice, une pandémie, et nous nous sommes engagés dans un chemin et un objectif que personne n’a jamais atteint — mettre au point un vaccin en un an », se félicitent les dirigeants des deux sociétés pharmaceutiques.
Mais les experts conseillent de rester prudent et de ne pas crier victoire trop rapidement : les deux laboratoires n’ont publié que quelques détails de leur essai clinique et leurs résultats n’ont pas encore été examinés par les pairs. Aucune information n’a été communiquée sur les effets secondaires observés, ni sur la durée de l’immunité procurée par ce vaccin. Aucune précision non plus sur la capacité de ce produit à prévenir les cas les plus graves de COVID-19 ou sur son innocuité vis-à-vis des personnes vulnérables ou âgées.
« Nous devons voir les données réelles, et nous aurons besoin de résultats à plus long terme », a déclaré Jesse Goodman, professeur de médecine et de maladies infectieuses à l’Université de Georgetown, et expert scientifique et médical chez GlaxoSmithKline. À savoir également que les doses de ce vaccin doivent être stockées à -70 °C, car l’ARN messager peut se dégrader rapidement ; cela risque de compliquer grandement la distribution, notamment dans les régions sans infrastructure adaptée.
Si cette efficacité spectaculaire se confirme, ce niveau de protection placerait le BNT162b2 au même niveau que les produits de vaccination utilisés et éprouvés depuis des décennies contre les maladies infantiles, comme la rougeole. Il serait en outre plus efficace que les vaccins antigrippaux développés chaque année.
Considéré comme l’un des projets de vaccin les plus avancés à ce stade, il fait partie de ceux qui ont été précommandés par l’Union européenne. Sur la base de projections, les deux entreprises ont déclaré qu’elles prévoyaient de fournir jusqu’à 50 millions de doses de vaccins dans le monde dès cette année et jusqu’à 1,3 milliard de doses en 2021. Une dizaine d’autres vaccins sont en cours d’essais cliniques de phase 3, dont celui développé par Moderna, qui utilise une technologie similaire (vaccin à ARNm) ; un porte-parole de Moderna a d’ailleurs récemment déclaré que des résultats provisoires seraient aussi bientôt disponibles.