Cet article est le premier d’une série de trois, et dont le but est de comprendre et bien sûr d’apprendre la construction des noms (parfois barbares comme par exemple le 4(3hydroxypropyle)hept-1,3-yne-1,7-diol) des molécules en chimie organique. Entrons ensemble dans le monde fabuleux du « langage moléculaire ».
Définitions
La chimie organique, qu’est-ce que c’est ? C’est tout simplement la chimie du carbone, essence de la vie – ainsi que de ses composés.
Une molécule est dite « organique » si elle contient des atomes de carbone (C) et d’hydrogène (H) liés entre eux. Ils peuvent aussi être reliés à d’autres atomes. Mais, les molécules organiques sont composées à partir d’un nombre restreint d’éléments. En plus des deux cités précédemment ((C) et (H) étant toujours présents), on retrouve très fréquemment l’oxygène (O) et l’azote (N). Selon les cas, on y retrouve aussi le fluor (F), le chlore (Cl), le brome (Br) ou l’iode (I). Ce groupe d’atomes constitue les halogènes. Dans la classification périodique, ils se situent dans la seconde colonne en partant de la droite, juste après la colonne des gaz rares.

Peuvent aussi apparaître dans les molécules organiques certains atomes de métaux (comme le magnésium (Mg)) ou des atomes non-métaux (comme le souffre).
Les différentes formules des molécules
Il existe différents types de formules pour écrire les molécules.
La formule brute
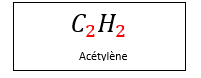
Dans la formule ci-dessus, on a en rouge le nombre d’atomes de la lettre qui le précède.
(ici carbone et hydrogène). On a donc grâce à ce type de formule le nombre et la nature des atomes qui constituent la molécule.
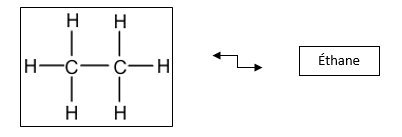
La formule développée

– Source : http://www.physique-chimie-lycee.fr/cours-seconde-chimie/sa05_5-representation-molecule.html
Ce type de représentation indique la disposition interne des atomes dans la molécule, c’est-à-dire la façon dont ils sont liés les uns aux autres.
Les « tirets » représentent les liaisons covalentes entre chaque atome.
→ La liaison simple est représentée par un tiret, comme présenté ci-dessus pour la molécule d’éthane. Toutes les liaisons de l’éthane sont simples.
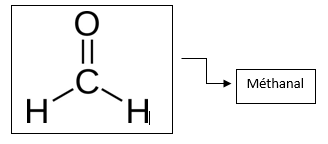
→ La liaison double est représentée par deux tirets, comme la molécule de méthanal (ou formaldéhyde, composé chimique à l’odeur piquante pouvant provoquer entre-autre une inflammation des voix respiratoires).
→ La liaison triple est représentée par trois tirets.
Afin de pouvoir construire ces molécules, il faut respecter la valence des atomes constitutifs de la molécule. Par définition, la valence d’un atome désigne le nombre d’atomes avec lesquels celui-ci peut se lier. Les schémas de Lewis définissent l’emplacement des électrons de valence (responsables des liaisons) autour de l’atome. Ces électrons sont responsables des liaisons entres les atomes afin de former des molécules. Voici les schémas de Lewis des principaux éléments que l’on retrouve en chimie organique :
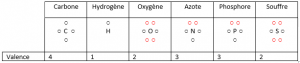
Chaque ○ représente un électron de valence. Ceux représentés en rouge sont appelés « doublets non liants ». Il s’agit d’une paire d’électrons appariés n’intervenant pas dans une liaison avec d’autres électrons. Ainsi, bien que l’atome d’azote dispose de 5 électrons de valence, il ne peut se lier qu’a 3 autres atomes.
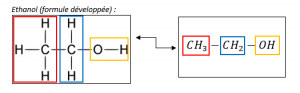
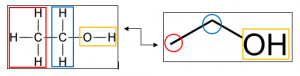
La formule semi-développée
C’est une abréviation de la formule développée.
La formule topologique
Dans cette représentation, les atomes de carbone n’apparaissent pas, ainsi que la plupart des atomes d’hydrogène. Les liaisons entre les carbones sont représentées par des segments.
Dans le prochain article qui fera suite à celui-ci, nous verrons les principales règles de nomenclature afin de nommer les composés chimiques organiques. Cela vous donnera ainsi un meilleur aperçu de la façon dont les molécules sont nommées. Nous plongerons ensemble dans les noms alambiqués des molécules organiques, et bien que ce travail puisse paraître fastidieux, il n’en est rien ! Au contraire, réussir à nommer des molécules diverses et variées peu même devenir un vrai jeu.


 L’électron est une particule élémentaire qui, avec les protons et les neutrons, constitue les atomes. C’est donc l’un des composants principaux de la matière baryonique. À ce titre, il revêt... [...]
L’électron est une particule élémentaire qui, avec les protons et les neutrons, constitue les atomes. C’est donc l’un des composants principaux de la matière baryonique. À ce titre, il revêt... [...]