C’est l’un des attributs qui distingue le plus l’Homme de ses proches parents : le cortex cérébral humain adulte est trois fois plus gros et possède presque deux fois plus de neurones que celui des grands singes. Des scientifiques apportent aujourd’hui une explication à cette différence : ils ont notamment découvert qu’un interrupteur moléculaire, inconnu jusqu’alors, contrôle la croissance des cellules cérébrales.
Le cerveau humain a subi une expansion rapide depuis que notre espèce a divergé des autres primates ; il est ainsi devenu le plus grand de tous les cerveaux de primates. Il atteint généralement environ 1500 cm3 à l’âge adulte, soit environ trois fois la taille du cerveau d’un gorille (500 cm3) ou du cerveau d’un chimpanzé (400 cm3). De précédentes études ont examiné les différences entre le développement cérébral de l’Homme et celui des rongeurs, mettant en évidence des divergences au niveau du comportement des progéniteurs neuraux, de la neurogenèse et de la cyto-architecture.
Les mécanismes régissant cette divergence d’évolution entre les primates et les rongeurs sont donc assez bien compris. En revanche, les changements apparus chez l’Homme par rapport aux singes restent à expliquer. Des biologistes se sont donc penchés sur la question et ont découvert plusieurs explications à l’hypertrophie du cerveau humain.
Une division cérébrale plus prolifique
Pour mener leur étude, les chercheurs ont collecté des cellules d’humains, de chimpanzés et de gorilles, puis les ont reprogrammées en cellules souches, qu’ils ont cultivées pour en faire de minuscules organoïdes cérébraux — soit de petites structures multicellulaires, de quelques millimètres, reproduisant la micro-anatomie du tissu cérébral.
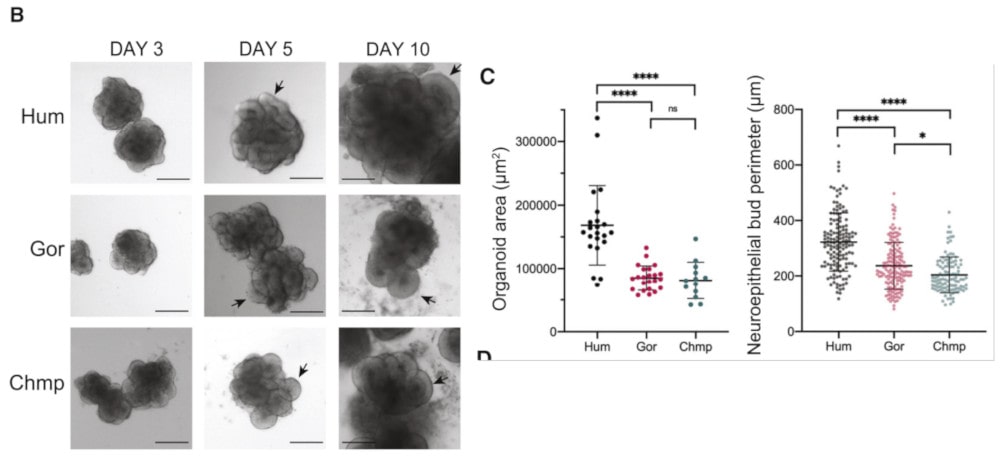
Après plusieurs semaines de développement, les organoïdes du cerveau humain étaient de loin les plus gros du lot. Et pour cause : les scientifiques ont découvert que dans le tissu cérébral humain, les cellules progénitrices neurales — qui fabriquent toutes les cellules du cerveau — se divisent davantage que celles du tissu cérébral des grands singes. « Nous avons constaté une différence de comportement cellulaire très, très tôt, qui permet au cerveau humain de grossir », a déclaré le Dr Madeleine Lancaster, biologiste du développement au Laboratoire de biologie moléculaire du Medical Research Council, à Cambridge.
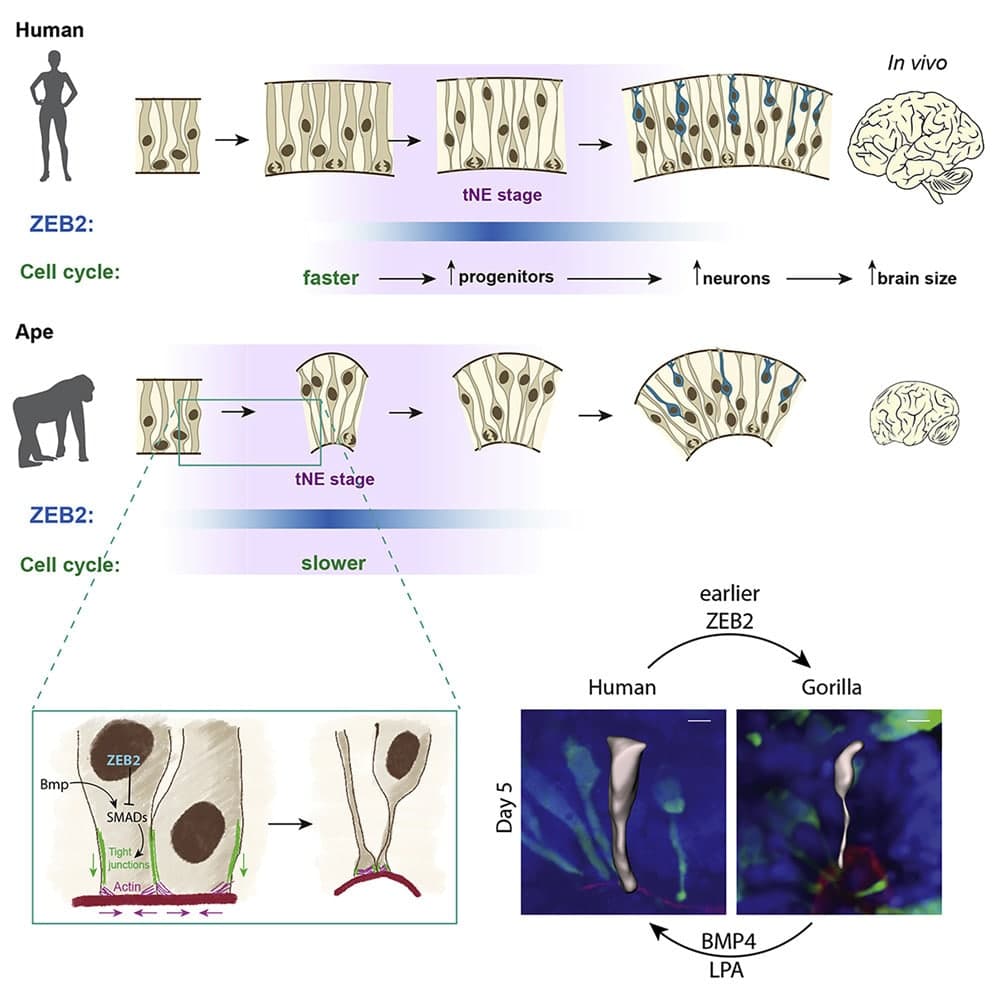
Or, lorsque vient l’étape de la différenciation des cellules cérébrales — qui comprend la fabrication des neurones —, le fait qu’il y ait beaucoup plus de cellules dans le tissu humain au départ entraîne l’augmentation de l’ensemble de la population de cellules cérébrales dans tout le cortex. La modélisation mathématique du processus a montré que la différence de prolifération cellulaire se produit si tôt dans le développement du cerveau, qu’elle conduit finalement à un quasi-doublement du nombre de neurones dans le cortex cérébral humain adulte par rapport à celui des grands singes.
Les organoïdes humains étaient systématiquement plus gros que les organoïdes de gorilles et de chimpanzés à un stade où les bourgeons neuroépithéliaux s’étaient formés et subissaient une expansion. Au cours de cette expansion, jusqu’au troisième jour après l’induction neurale, la taille et l’architecture des tissus des trois espèces étaient très similaires. Mais au cinquième jour, les organoïdes de gorille et de chimpanzé ont présenté des bourgeons neuroépithéliaux circulaires plus arrondis que ceux des organoïdes humains, qui adoptaient plutôt une forme allongée.
Un gène identifié comme régulateur de croissance cellulaire
Les résultats obtenus mettent en évidence que la différenciation neuroépithéliale est un processus prolongé chez les singes, qui implique un état de transition auparavant non reconnu caractérisé par un changement de forme cellulaire. Au cours de cette transition, les changements de forme cellulaire se produisent avant le changement d’identité cellulaire et le début de la neurogenèse. Il apparaît que les organoïdes humains sont plus gros en raison d’un retard dans cette transition morphologique, associé à des différences de migration nucléaire intercinétique (un déplacement du corps cellulaire propre à la division neurogénique) et de longueur de cycles cellulaires (plus courts chez l’Homme).


En outre, les chercheurs ont identifié un gène crucial impliqué dans ce processus. Ils ont constaté que ce gène, nommé Zeb2, s’active plus tard dans les tissus humains que dans les tissus de singes, retardant d’autant la phase de transition. Par conséquent, les cellules humaines ont davantage de temps pour se diviser et mûrir. Ce gène semble agir en quelque sorte comme un interrupteur de croissance cellulaire : des tests ont montré en effet que retarder les effets de Zeb2 faisait grossir le tissu cérébral des gorilles. À l’inverse, l’activer plus tôt dans les organoïdes du cerveau humain les faisait croître comme ceux des singes.
John Mason, professeur de développement neuronal moléculaire à l’Université d’Édimbourg, qui n’a pas participé à cette recherche, fait remarquer que cette étude est une nouvelle preuve de l’intérêt des organoïdes dans le cadre des recherches sur le développement du cerveau. Il souligne par ailleurs qu’une meilleure compréhension du développement cérébral est indispensable pour identifier la façon dont les troubles neurodéveloppementaux peuvent survenir. « La taille du cerveau peut être affectée dans certains troubles du neuro-développement, par exemple la macrocéphalie est une caractéristique de certains troubles du spectre autistique », explique le spécialiste. Ainsi, la compréhension de ces processus fondamentaux du développement embryonnaire du cerveau pourrait conduire à une meilleure compréhension, voire une meilleure prévention, de ces troubles.