La recherche dans le domaine des maladies neurodégénératives avance à grands pas ces dernières années, de nombreuses études se concentrant sur la plus fréquente d’entre elles, la maladie d’Alzheimer — qui touche environ 44 millions de personnes dans le monde. Une équipe collaborative de chercheurs a récemment mis au point un modèle expliquant la progression de la maladie dans le cerveau humain, dont notamment la vitesse de différents processus menant à la démence.
Les résultats auront des applications directes selon les experts, notamment dans le développement de nouveaux traitements candidats. D’ailleurs, certaines hypothèses proposées précédemment et expliquant la progression de la maladie devront être revues, car c’est ici la première fois que des chercheurs utilisent des données issues de patients humains pour créer un tel modèle. Les résultats ont été publiés dans la revue Science Advances.
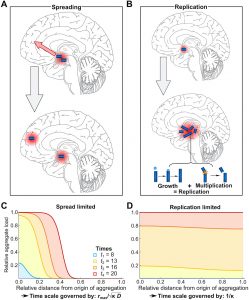
L’avancée découlant de cette étude ne se résume pas qu’au modèle mathématique proposé, mais aussi à une découverte majeure : les scientifiques ont constaté qu’au lieu de partir d’un point unique dans le cerveau et de déclencher une réaction en chaîne conduisant à la mort des cellules cérébrales, comme on le pensait jusqu’à présent, la maladie d’Alzheimer atteint très tôt différentes régions du cerveau. La vitesse à laquelle la maladie provoque la mort les cellules de ces régions, par la production d’amas de protéines toxiques, limite la vitesse à laquelle la maladie progresse globalement.
Une formule mathématique pour expliquer la progression de la maladie
L’équipe internationale de chercheurs, dirigée par l’université de Cambridge, a utilisé des échantillons de cerveau post-mortem de patients atteints de la maladie d’Alzheimer, ainsi que des scanners TEP de patients vivants, pour suivre l’agrégation de la protéine tau, l’une des deux protéines clés impliquées dans la maladie. Les patients étaient séparés en plusieurs catégories, allant de ceux présentant une déficience cognitive légère sans diagnostic de maladie d’Alzheimer confirmé à ceux ayant un diagnostic confirmé.
Les symptômes les plus communs sont la perte de mémoire, les changements de personnalité et les difficultés à accomplir certaines tâches quotidiennes. Si Alzheimer est si difficile à étudier, c’est en partie car elle se développe sur plusieurs décennies. Un diagnostic définitif ne peut être posé qu’après examen d’échantillons de tissu cérébral.
La principale cause connue de la démence, apparaissant à un certain stade d’évolution de la maladie, est l’accumulation de protéines toxiques (appelés agrégats) dans le cerveau. Les deux protéines clés connues à ce jour sont la tau et la bêta-amyloïde, qui s’accumulent en enchevêtrements et en plaques, provoquant ainsi la mort des cellules cérébrales et une atrophie progressive du cerveau.
En combinant cinq ensembles de données différents et en les appliquant au même modèle mathématique (une formule mathématique), les chercheurs ont observé que le mécanisme qui contrôle le rythme de progression de la maladie d’Alzheimer est la réplication des agrégats dans les régions individuelles du cerveau, et non la propagation des agrégats d’une région à l’autre.
Pendant de nombreuses années, les processus cérébraux à l’origine de la maladie d’Alzheimer, étudiés majoritairement sur des modèles animaux, ont été décrits à l’aide de termes tels que « cascade » et « réaction en chaîne ». Cela est notamment dû au fait que, par exemple, les résultats obtenus sur des souris suggéraient que la maladie d’Alzheimer se propageait rapidement, car les amas de protéines toxiques colonisaient différentes parties du cerveau à partir d’un point de départ dans ces modèles. Mais comme le suggère cette étude portant uniquement sur les humains, ce n’est pas le cas.
Non pas un, mais plusieurs chevaux de Troie…
« On pensait que la maladie d’Alzheimer se développait d’une manière similaire à de nombreux cancers : les agrégats se forment dans une région et se propagent ensuite dans le cerveau », a déclaré dans un communiqué le Dr Georg Meisl du département de chimie Yusuf Hamied de Cambridge, auteur principal de l’étude. « Mais au lieu de cela, nous avons découvert que lorsque la maladie d’Alzheimer commence, il y a déjà des agrégats dans plusieurs régions du cerveau, et donc que tenter d’arrêter la propagation entre les régions ne fera pas grand-chose pour ralentir la maladie ».
En d’autres termes, la maladie débute à plusieurs endroits en même temps (ou presque), comme si une armée parvenait à déployer non pas un, mais plusieurs chevaux de Troie à l’intérieur d’une ville protégée, pour ne laisser aucune chance à l’ennemi. Les experts pensent que c’est en partie pour cela que la maladie est aussi fulgurante (8 à 12 ans d’espérance de vie en moyenne dès le diagnostic) et que sa progression était jusqu’ici si difficile à cerner.
Comme mentionné précédemment, il s’agit de la première fois que des données humaines sont utilisées pour suivre les processus qui contrôlent le développement de la maladie d’Alzheimer au fil du temps. L’étude a été rendue possible en partie par l’approche de la cinétique chimique développée à Cambridge au cours de la dernière décennie, qui permet de modéliser les processus d’agrégation et de propagation dans le cerveau, ainsi que par les progrès de la tomographie par émission de positons (TEP) et l’amélioration de la sensibilité d’autres mesures du cerveau.
« Cette recherche montre l’intérêt de travailler avec des données humaines plutôt qu’avec des modèles animaux imparfaits », a déclaré l’un des co-auteurs principaux, le professeur Tuomas Knowles, également du département de chimie de l’université de Cambridge. « Il est passionnant de voir les progrès dans ce domaine – il y a quinze ans, les mécanismes moléculaires de base ont été déterminés pour des systèmes simples dans une éprouvette par nous et d’autres ; mais maintenant, nous sommes en mesure d’étudier ce processus au niveau moléculaire chez de vrais patients, ce qui est une étape importante pour un jour développer des traitements ».
Agir sur les facteurs clés de progression pour freiner la maladie
Dans leur document, les chercheurs montrent que la réplication des agrégats de protéines tau est étonnamment lente : jusqu’à cinq ans. « Les neurones sont étonnamment bons pour empêcher la formation d’agrégats, mais nous devons trouver des moyens de les rendre encore meilleurs si nous voulons développer un traitement efficace », a déclaré le coauteur principal David Klenerman, du UK Dementia Research Institute de l’université de Cambridge. « C’est fascinant de voir comment la biologie a évolué pour arrêter l’agrégation des protéines ».
La méthodologie présentée dans l’étude pourrait être utilisée pour aider au développement de traitements contre Alzheimer en ciblant les mécanismes clés. En outre, la méthodologie pourrait être appliquée à d’autres maladies neurodégénératives, comme la maladie de Parkinson. « La principale découverte est que le fait d’arrêter la réplication des agrégats plutôt que leur propagation sera plus efficace aux stades de la maladie que nous avons étudiés », explique Knowles. Les chercheurs prévoient maintenant d’examiner les processus précoces dans le développement de la maladie et d’étendre les études à d’autres pathologies, telles que la démence fronto-temporale, les lésions cérébrales traumatiques et la paralysie supranucléaire progressive, où des agrégats de tau se forment également au cours de la maladie.
Les conclusions ouvrent de nouvelles voies pour comprendre la progression de la maladie d’Alzheimer et d’autres maladies neurodégénératives, ainsi qu’un espoir de développer de nouveaux traitements ralentissant efficacement l’évolution de la maladie, en agissant de façon « préventive » sur les facteurs de progression présentés.