Pfizer vient d’annoncer les premiers retours sur son essai clinique d’un traitement contre la COVID-19, en cours depuis le 16 juillet. D’après la firme pharmaceutique, sa pilule réduit les risques d’hospitalisation et de décès de 89%. L’effet est si important que les recrutements pour la suite de l’essai clinique ont été stoppés, compte tenu de « l’efficacité écrasante » du traitement, selon Pfizer. Les premiers résultats seront publiés d’ici le 25 novembre.
Serait-ce l’avènement d’une nouvelle ère où la COVID-19 sera combattue par une pilule à prendre en cas d’infection, en plus des vaccins déjà disponibles en prévention ? C’est ce que semble promettre l’annonce tonitruante de Pfizer concernant son traitement antiviral expérimental paxlovid, associant la joliment nommée PF-07321332 et le ritonavir, un antirétroviral. En effet, le paxlovid diminuerait de 89% les risques d’hospitalisation et de décès chez les personnes recrutées pour l’essai.
Pfizer n’est pas le premier à se lancer sur le créneau de la pilule miracle. Le molnupiravir de Merck a déjà atteint le 1er novembre des résultats intermédiaires en phase II/III — phase d’essai clinique accélérée pour tester l’efficacité d’un traitement — si impressionnants qu’il a été autorisé jeudi au Royaume-Uni, que la France en a commandé 50 000 pilules et que l’Europe semble considérer sa prochaine commercialisation. Alors que le molnupiravir mime une brique de l’ARN — le cousin de l’ADN qui porte l’information génétique des coronavirus — et empêche ainsi la réplication du virus, le mécanisme d’action du paxlovid cible le SARS-CoV-2 plus en amont dans son cycle de vie.
Empêcher le virus de prendre le contrôle de la cellule
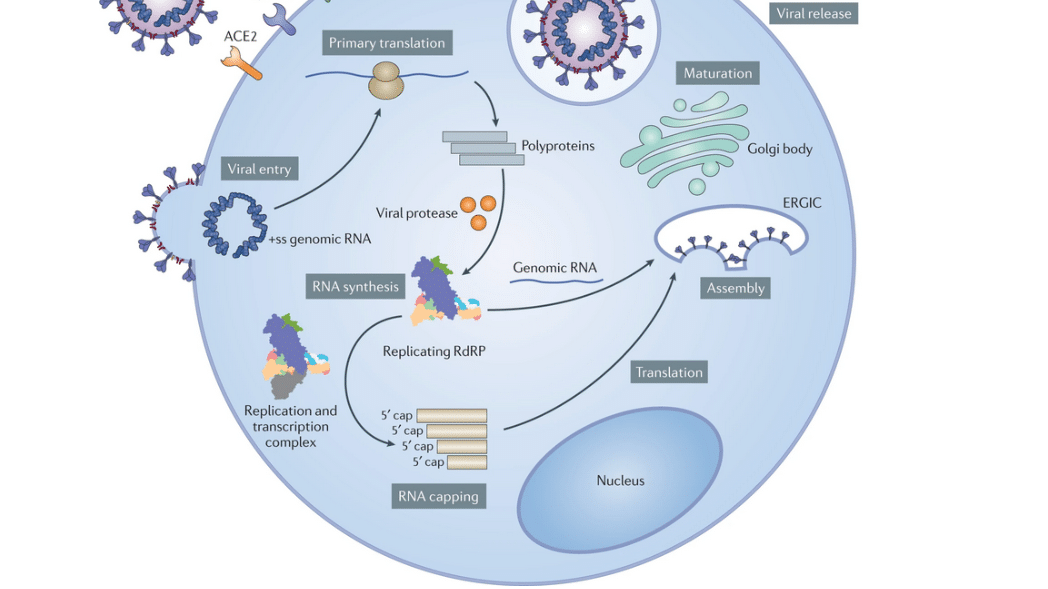
Dans le paxlovid, PF-07321332 fait le gros du travail. Cette molécule inhibe la principale protéase — protéine catalysant la coupure des protéines — du SARS-CoV-2, 3CLpro ou Mpro. Pour comprendre l’impact de cette inhibition, il faut revenir au cycle viral du SARS-CoV-2. Une fois intégré dans la cellule infectée, le génome du SARS-CoV-2 est traduit en protéine une première fois, sous la forme de deux polyprotéines produites en quantités à peu près égales, ORF1a et ORF1b. À elles deux, elles regroupent 16 protéines non structurales (ou NSP), c’est-à-dire exprimées dans la cellule-hôte, mais absentes de la particule virale.
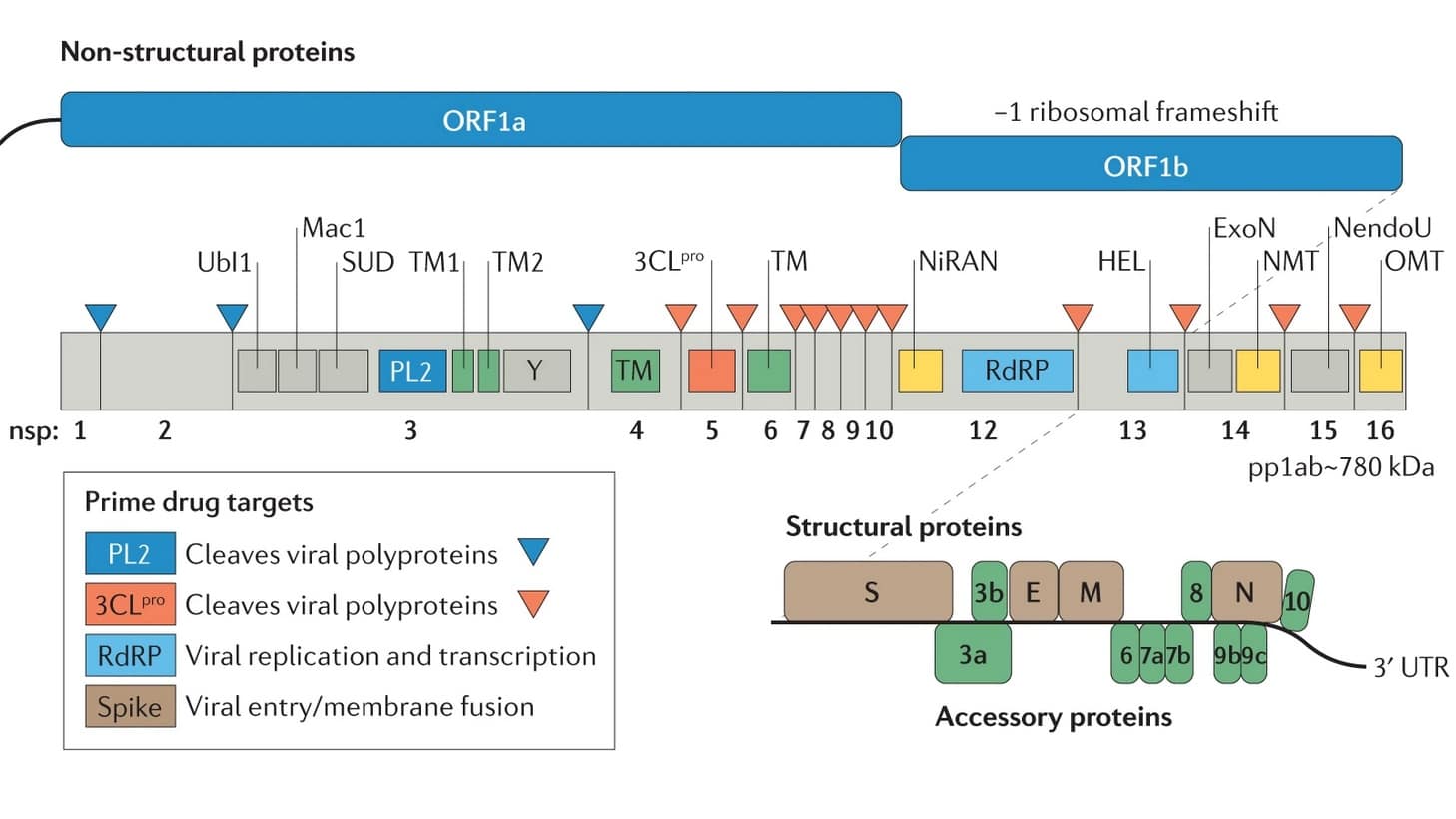
Ces NSP sont de vraies teignes, vitales au succès du coronavirus : tandis que les unes paralysent les défenses contre le virus, les autres transforment la cellule infectée en usine à particules virales, prêtes à infecter d’autres cellules. Mais lorsqu’elles sont encore coincées dans ORF1a et ORF1b, les NSP ne sont pas fonctionnelles. C’est la protéine Mpro qui les sépare les unes des autres. Cette segmentation des protéines virales, essentielle à leur activation et donc au cycle de reproduction viral, s’appelle la protéolyse.
En empêchant cette protéolyse, PF-07321332 transforme la cellule infectée en tombeau pour le virus, incapable d’y proliférer et d’en sortir. Dérivé du lufotrelvir, un antiviral expérimental développé par Pfizer contre le SARS-CoV-2 et ciblant également Mpro, PF-07321332 présente l’avantage sur son ancêtre de pouvoir être administré par voie orale et non par voie intraveineuse. Enfin, le paxlovid contient également du ritonavir. Cet antirétroviral, déjà prescrit contre le VIH, est utilisé ici pour ralentir la digestion de PF-07321332 par les enzymes cellulaires et lui permettre de rester actif plus longtemps.


Un essai en phase II/III prometteur
Le paxlovid est testé depuis le 16 juillet dans un essai clinique en phase II/III randomisé en quadruple aveugle sur des patients atteints de la COVID-19, non vaccinés et à risque. « Randomisé » signifie que les patients se faisant administrer un placebo et ceux recevant le paxlovid sont choisis de manière aléatoire et équiprobable, et « quadruple aveugle » signifie que ni les patients, ni les personnels soignants, ni les médecins coordonnant l’essai, ni les chercheurs analysant les données ne savent qui a reçu quoi.
Les patients ont pris du paxlovid pendant 5 jours, toutes les 12 heures. Les résultats préliminaires annoncés par Pfizer — la publication devrait arriver d’ici le 25 novembre — indiquent que 1,0 % des patients ayant reçu le paxlovid dans les 5 jours après l’apparition des symptômes sont hospitalisés au jour 28 d’observation (6/607), contre 6,7 % des patients ayant reçu le placebo (41/612, dont 10 morts). Pendant ce temps-là, d’autres laboratoires sont toujours en course pour développer leur propre pilule, dont l’Institut Pasteur de Lille qui recherche des participants pour son essai clinique.



