En France, plus de 500 patients en attente d’une greffe d’organe meurent chaque année. Afin de pallier le déficit, la biologie synthétique offre — depuis une dizaine d’années — un avenir prometteur avec le développement des organoïdes. Ces tissus humains organiques cultivés à partir de cellules souches in vivo imitent le fonctionnement des tissus dont ils dérivent. Personnalisation de la médecine et des traitements, alternative à l’utilisation d’animaux, transplantation sans rejet et sans pénurie… autant d’avantages à (peut-être) reproduire un jour tous les organes humains en laboratoire.
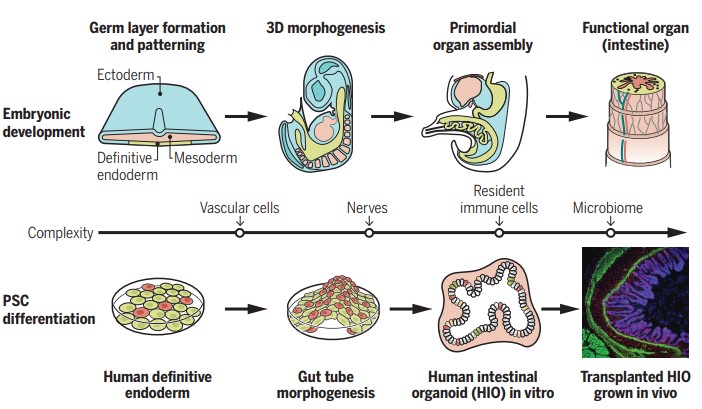
Le début de l’histoire ne date que d’il y a 13 ans. En 2009, le laboratoire de Hans Clevers (de l’Hubrecht Institut aux Pays-Bas) publie pour la première fois une étude qui montre un organoïde d’intestin. Le chercheur néerlandais a longtemps soupçonné les cellules souches des intestins d’être les principaux moteurs de leur régénération. Il a d’abord développé une technique génétique pour cultiver des cellules souches LGR5 en laboratoire, puis a conçu des intestinoïdes qui pourraient servir à tester les médicaments en toute sécurité sur des tissus intestinaux humains actifs.
Les organoïdes sont définis comme des structures produites à partir de cellules souches et combinant trois propriétés : « La coexistence de multiples types cellulaires ; une architecture proche de celle du tissu d’origine ; et une mise en œuvre de fonctions propres au tissu », résume Denis Duboule, professeur de génétique et génomique à l’université de Genève, dans son cours au Collège de France. De la taille d’une lentille et développés en une dizaine de jours, ces « mini-organes » ont ouvert la porte au développement d’autres organoïdes en laboratoire, notamment le cœur, le foie, les reins… et le cerveau !
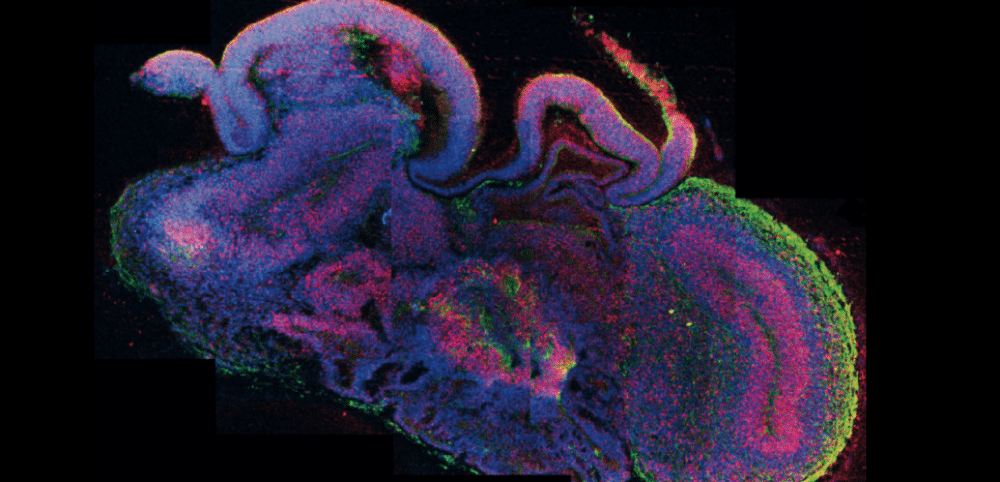
Aussi appelés « cérébroïdes » ou « mini-cerveaux » (bien que ce dernier terme soit abusif d’après les scientifiques), ce sont des structures constituées de plusieurs types de cellules nerveuses. Ces dernières sont capables de s’auto-organiser en 3D pour représenter les aspects d’un tout jeune cerveau fœtal humain, mais sans la fonction cognitive.
L’utilité des organoïdes
« Pouvant être maintenus en culture beaucoup plus longtemps qu’une biopsie et étant beaucoup plus fonctionnels que les cultures 2D, les organoïdes ont une place incontestable en tant que modèles d’étude de compréhension des mécanismes de la physiologie et de la physiopathologie », explique à l’INSERM Nathalie Vergnolle, qui fabrique des organoïdes intestinaux et vésicaux pour l’étude des maladies intestinales ou vésicales (cystite, cancer de la vessie) et de leurs traitements. « En effet, nous nous sommes aperçus que les organoïdes issus de tissus malades n’ont pas les mêmes morphologies et comportements que ceux provenant de tissus sains ».
Devenus de très bons outils en recherche, les organoïdes permettent aussi aux fournisseurs de soins de santé de tester des traitements, même agressifs (par exemple contre le cancer), sans faire mal au patient. Les effets secondaires dus aux médicaments, responsables de 5% du nombre des admissions dans les hôpitaux européens, pourraient ainsi être évités avec les organoïdes. Ces effets secondaires représentent également la cinquième cause la plus fréquente de décès à l’hôpital.
Cette technique permet donc de reproduire les tumeurs cancéreuses, les « tumoroïdes », qui sont développées dans le but de tester de manière sécurisée (hors du corps humain) les effets des thérapies potentielles destinées aux nouvelles formes de cancer. D’après une étude de 2019, des chercheurs sont parvenus à recréer in vitro des tumeurs en seulement deux semaines, à partir de cellules tumorales de 24 patients atteints de cancer du pancréas. Ils ont ainsi pu dépister la suractivation de MYC (protéine qui contribue à la progression tumorale) et tester deux médicaments anti-MYC en développement. L’un d’eux s’est d’ailleurs révélé jusqu’à dix fois plus efficace que l’autre pour faire régresser la tumeur.
« Nous avons établi la preuve de principe de l’utilité des organoïdes pour classifier les tumeurs et tester des médicaments dans le cancer du pancréas », estime Juan Iovanna, chercheur de l’étude. « Nous souhaitons maintenant trouver des marqueurs prédictifs de réponse à l’ensemble des médicaments disponibles pour administrer les traitements les plus adaptés aux patients. La technique nécessite des ressources et des compétences particulières, mais elle représente à ce jour le meilleur outil de progression vers la médecine personnalisée dans ce cancer ».
« Nous ne sommes qu’au début de l’aventure »
La médecine personnalisée ayant le vent en poupe, cette biologie de synthèse s’inscrit parfaitement dans l’ère du temps. En effet, les organoïdes sont en adéquation avec le profil génétique d’un patient unique, au contraire des essais cliniques actuels qui évaluent les effets des médicaments sur la population mais pas sur les patients individuels. Encore à un stade précoce, cette médecine serait idéale pour certains types de cancers peu sensibles aux traitements.
Encore plus surprenants, les organoïdes cérébraux permettent d’étudier les maladies neurodégénératives, comme la sclérose latérale amyotrophique. Malheureusement, leur durée de vie est souvent limitée. Des chercheurs ont tout de même réussi à développer et à maintenir en vie des cérébroïdes pendant plus d’un an. « Les cérébroïdes n’ont que sept ans d’existence. Nous ne sommes qu’au début de l’aventure », assure au Monde en 2020 Frank Yates, chercheur à la tête du projet sur les cérébroïdes que développent le CEA et l’école d’ingénieurs Sup’Biotech, à Fontenay-aux-Roses.
Dès 2013, les scientifiques ont pu modéliser jusqu’aux dix premières semaines de développement d’un cerveau de fœtus humain. Dans la suite du développement, ces structures finissent par comporter de larges trous : au centre, leurs cellules se nécrosent, faute d’irrigation. En effet, dans les cérébroïdes actuels, on ne trouve ni les cellules immunitaires qui peuplent un cerveau humain, ni les vaisseaux sanguins qui l’irriguent.
Vers le développement d’usines à organes ?
Il est aussi important de considérer les organoïdes comme une solution possible à la pénurie d’organe. Comme l’a annoncé mercredi 12 janvier l’agence sanitaire qui gère les greffes d’organes, plus de 5000 transplantations ont été réalisées en France en 2021, un niveau encore nettement inférieur à l’avant-crise sanitaire. Cela étant, l’une des problématiques majeures reste le risque du rejet… difficulté que semblent contourner les organoïdes.
Des chercheurs américains ont par exemple recréé en laboratoire des cellules pancréatiques (capables de produire de l’insuline), dont le dysfonctionnement est à l’origine du diabète. Ces organoïdes ont été modifiés pour échapper au système immunitaire, permettant leur transplantation sans risque de rejet.
En outre, les organoïdes proposent une alternative viable aux tests sur les animaux, qui posent des problèmes éthiques, mais aussi parce que les réactions aux médicaments varient de manière significative entre les humains et les animaux. Mais les cobayes animaux sont encore loin d’être oubliés des laboratoires… Même si les techniques alternatives permettent de réduire la dépendance de la recherche pour les animaux, elles ne peuvent pas encore totalement les remplacer, d’après une étude américaine parue en 2017. Elles ne pourront tout simplement jamais être aussi complètes et représentatives que le modèle animal. Selon l’INSERM, les organoïdes permettent de mieux comprendre la complexité du vivant sans pour autant en devenir un substitut.
Alors, allons-nous vers le développement d’usines d’organes ? Avec les progrès de l’ingénierie biologique, les scientifiques sont déjà capables de fabriquer des organes simples et fonctionnels en laboratoire. À ce rythme, peut-être que dans une dizaine d’années les humains ayant besoin d’une greffe d’organe pourront simplement le commander à un laboratoire.
En revanche, fabriquer des organoïdes prend du temps, parfois plusieurs mois pour des cérébroïdes, et cela coûte cher. En comparaison, les cultures cellulaires in vitro en 2D existent depuis des décennies et sembleraient parties pour rester, même si la 3D pourrait autrement l’éclipser. « Elles restent simples et peu chères comparativement. Elles auront donc leur utilité en première approche », assure Karim Si-Tayeb, chercheur en biologie.
Et la bioéthique dans tout cela ? Si l’on considère que ces organoïdes peuvent devenir des « micro-cœurs » ou « micro-cerveaux » avec toutes les caractéristiques du tissu cérébral embryonnaire, alors il faut des garde-fous. Est-il possible que les cerveaux cultivés en laboratoire finissent par développer une conscience ? Rien n’est moins sûr.


