La stimulation électrique peut faciliter la cicatrisation des plaies avec une efficacité élevée et des effets secondaires limités. Cependant, les dispositifs de stimulation électrique actuels montrent un certain nombre d’obstacles pour une utilisation pratique, notamment au niveau de la rigidité et de la taille. Un patch électronique flexible (ePatch) récemment développé dont les électrodes sont composées d’un hydrogel conducteur, a permis une amélioration significative de la gestion des plaies dans des modèles animaux, avec une action antibactérienne efficace. Une révolution pour le traitement des plaies chroniques.
Nous connaissons tous une multitude de causes provoquant des plaies cutanées : objet tranchant (couteau, machine, débris de verre, etc.), choc (chute de vélo, accident de sport, etc.), morsure (humaine ou animale), brûlure etc. Notre peau est mise à rude épreuve. Elles peuvent également être le résultat d’une chirurgie. Ainsi, la cicatrisation d’une plaie s’avère plus ou moins longue, selon sa nature (aiguë ou chronique, superficielle, profonde), mais aussi de l’état de santé général du patient — insuffisances vasculaires, diabète, obésité et âge avancé —, et encore de ses habitudes de vie. Dans les cas graves, des processus de cicatrisation anormaux (dans le cas du diabète par exemple) peuvent entraîner des plaies chroniques (pouvant aller jusqu’à l’amputation), une condition qui peut affecter considérablement la mobilité, la qualité de vie et les coûts des soins de santé.
La plaie aiguë (brûlure, coupure, écorchure, etc.) cicatrise plus vite (entre 2 et 4 semaines environ) que la plaie chronique (près de 7 mois), et de façon analogue pour les plaies superficielles face aux plaies touchant les couches plus profondes de la peau.
De manière simple, le processus de cicatrisation se décompose en 3 étapes. En premier lieu, il y a la phase de détersion ou exsudative, sitôt après la blessure, durant laquelle la plaie « se débarrasse » des tissus dévitalisés ou abîmés et surtout, elle est accompagnée d’un phénomène inflammatoire. L’inflammation est le témoin de l’entrée en jeu des défenses immunitaires de l’organisme, pour le débarrasser de tous les germes pathogènes qui ont pénétré dans la peau, de façon à éviter une infection. Puis vient la phase de bourgeonnement, où le processus de réparation se met en place, pour combler progressivement la plaie via une production intensive de collagène et de nouveaux vaisseaux sanguins. Ceux-ci remplaceront ceux qui ont été détruits. En dernier lieu, la phase d’épidermisation conclut la cicatrisation. Petit à petit, et en partant des bords, la plaie — soumise à d’imperceptibles contractions — se referme enfin.
Actuellement, les soins apportés pour la cicatrisation des plaies vont des pansements aux bandages à pression négative, en passant par les médicaments à base de facteur de croissance et anti-inflammatoires, le débridement et les traitements par ultrasons. Cependant, même dans les meilleures conditions, le temps moyen de fermeture complète d’une plaie est de 10-12 semaines avec ces méthodes.
Récemment, des chercheurs de l’Institut Terasaki pour l’innovation biomédicale (TIBI) ont mis au point un patch électronique flexible et imprimable permettant de réduire de moitié le temps de cicatrisation des plaies, en tuant les bactéries nocives et minimisant les cicatrices. Les détails sont publiés dans la revue Biomaterials.
La stimulation par champ électrique et ses inconvénients
Le concept de base du nouveau pansement est la stimulation par champ électrique (stimulation EF), dont il a déjà été démontré qu’elle accélère le processus de guérison avec des effets secondaires limités. L’administration d’une stimulation EF au niveau de la plaie active la migration de la peau et d’autres cellules de granulation vers le site. Elle induit la formation de vaisseaux sanguins et contrôle l’inflammation excessive.
En conséquence, des dispositifs de stimulation EF portables ont été conçus, montrant des améliorations dans les temps de cicatrisation des plaies. Cependant, l’encombrement et la rigidité des électrodes utilisées rendent presque impossible la bonne conformation avec la plaie. Ceci augmente le potentiel d’inflammation et de cicatrisation prolongée, contrairement à l’objectif premier. De surcroît, la fabrication de ces électrodes nécessite des technologies couteuses. Le nouveau ePatch tend donc à surmonter ces obstacles en étant bien plus facile à produire et à utiliser.
Une conception inédite et personnalisable
Partant des expériences des précédentes versions de la stimulation par champ électrique, l’équipe utilise des électrodes constituées de nanofils d’argent, mélangés à un hydrogel dérivé d’algues connu sous le nom d’alginate. Ce dernier est déjà utilisé dans les pansements chirurgicaux, car il est biocompatible et maintient un taux d’humidité optimal. De leur côté, les nanofils offrent non seulement des propriétés antibactériennes, mais également une conductivité élevée sous contrainte.
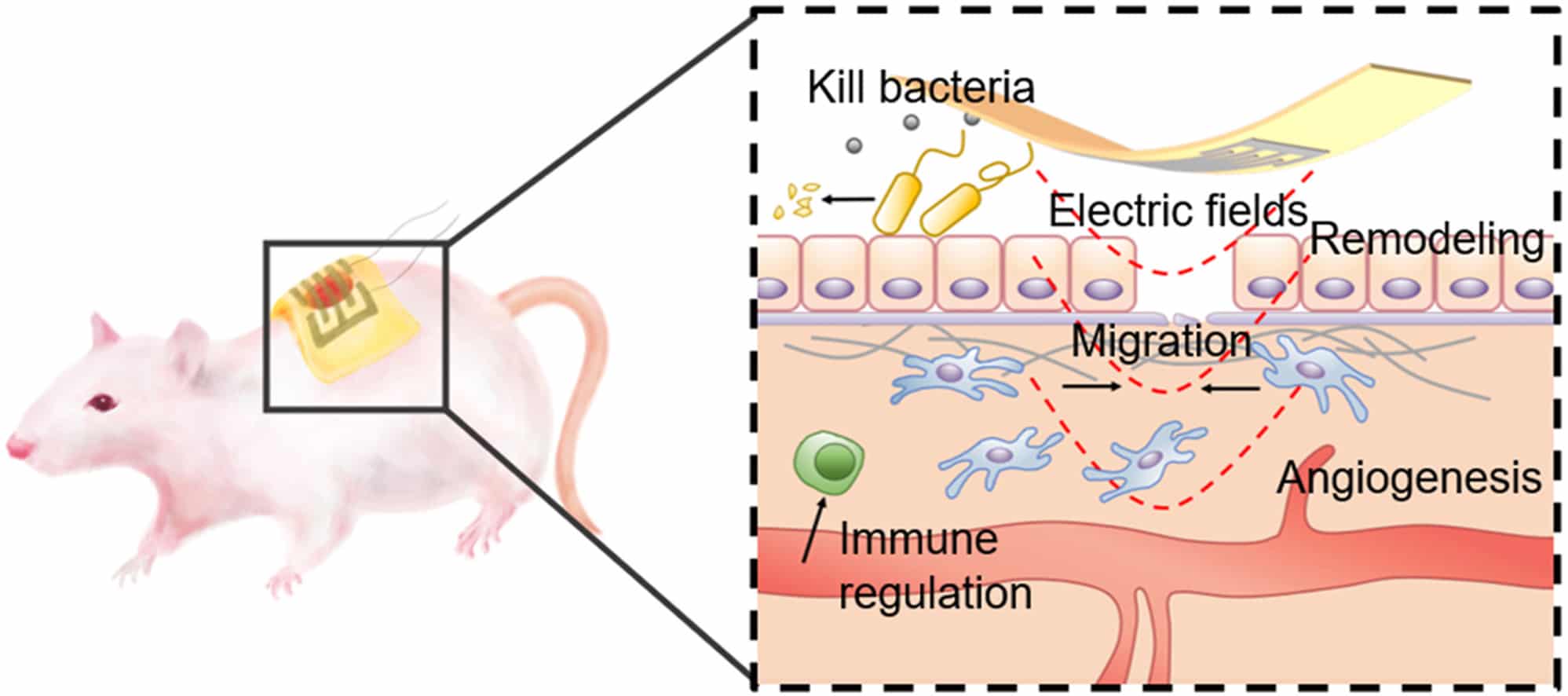
Ensuite, par une modification chimique de l’alginate et l’ajout de calcium, les chercheurs ont produit un matériau qui augmente la stabilité et améliore la fonction des électrodes. Notons que le calcium ajouté au mélange induit la prolifération et la migration des cellules vers le site de la plaie, ce qui à son tour favorise la formation de vaisseaux sanguins.
En ajustant davantage le rapport nanofils d’argent/alginate modifié, ils ont obtenu un gel flexible et imprimable (par impression 3D). Cet hydrogel est nommé « bio-encre ». Cette conception permettrait de créer un patch avec une conformité personnalisable selon diverses formes et tailles de plaies. De manière concrète, pour fabriquer l’ePatch, un gabarit a été appliqué sur une feuille de silicone et la bio-encre a été déposée sur le gabarit. Lors de la solidification de la bio-encre, le modèle a été retiré.
Un patch prometteur dans les modèles animaux
Lors de tests mécaniques, les dispositifs e-Patch se sont montrés stables, avec une tolérance aux contraintes suffisante pour être considérés comme adaptés à une application sur la peau. Par suite, les tests cellulaires ont prouvé une augmentation de la prolifération cellulaire, de la migration, de l’agrégation, de l’alignement et une sécrétion accrue de facteurs de croissance. Enfin, des études sur des modèles animaux (des rats présentant des plaies ouvertes) ont prouvé des résultats de cicatrisation « considérablement accélérés », selon les auteurs, lorsqu’un courant électrique était délivré dans le patch.
Mais il y avait également un processus de cicatrisation plus directionnel, entraînant une cicatrisation plus fine — la cicatrice est minime —, le dépôt de couches de peau normales et la croissance des poils après la fermeture de la plaie. Ces pansements ont fait passer le temps de fermeture de la plaie de 20 jours (groupe témoin) à seulement 7 jours (rats traités avec l’ePatch), soit une guérison presque 3 fois plus rapide.
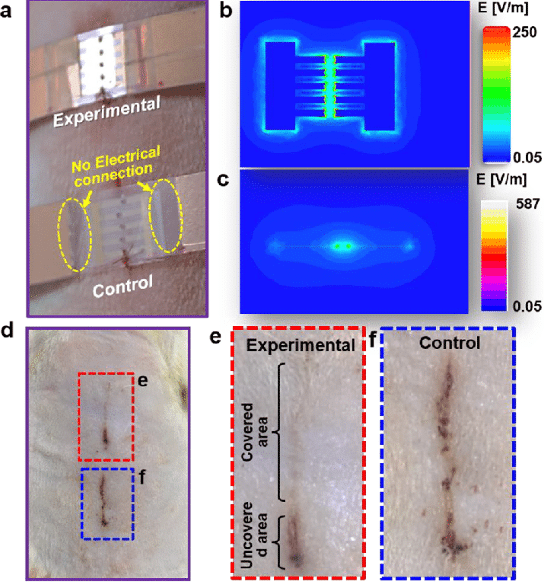


De plus, lorsque les ePatchs ont été retirés à la fin du processus de guérison, les rats traités ont montré moins de cicatrices que le groupe témoin. Cela est probablement dû, du moins en partie, au fait que les cellules de la peau ne collent pas au substrat en silicone, et de ce fait ne se détachent pas lorsque le pansement est retiré.
Han-Jun Kim, chercheur au TIBI, conclut dans un communiqué : « Grâce à une sélection rigoureuse des matériaux et à l’optimisation de notre formulation de gel, nous avons pu développer un e-Patch multifonctionnel, facile à fabriquer et rentable, qui facilitera et accélérera grandement la cicatrisation des plaies ».


