Des chercheurs de l’Université de Californie à San Francisco ont découvert le mécanisme qui pourrait être à l’origine du syndrome de l’intestin irritable — un trouble bénin, mais qui pèse lourdement sur la qualité de vie des malades et qui touche au moins 5% de la population française (plus fréquemment les femmes). Leurs expériences menées sur des souris ont révélé la présence de cellules intestinales particulières, dont l’activité pourrait être à l’origine de la douleur intestinale chronique et de la perturbation du transit, qui caractérisent la maladie.
Le syndrome de l’intestin irritable (ou SII) est un trouble gastro-intestinal courant, qui affecte les fonctions normales des intestins. Il provoque des douleurs abdominales récurrentes (spasmes, brûlures, ballonnements), de la diarrhée et/ou de la constipation. Les personnes atteintes du SII ont des intestins plus sensibles et de ce fait, réagissent mal à des aliments qui ne provoquent aucune gêne chez les autres. Les repas trop gras, les aliments riches en fibres, l’alcool, la caféine, de même que certains médicaments ou le stress, sont connus pour provoquer des crises.
À ce jour, il n’existe pas de traitement spécifique pour guérir du SII, car son origine reste mal comprise. La prise en charge de la maladie consiste à diminuer la douleur et l’inconfort des patients. Certaines études ont montré qu’une partie des malades possède une perméabilité intestinale accrue, favorisant le passage de molécules pro-inflammatoires dans l’organisme qui seraient à l’origine d’une réaction inflammatoire diffuse. Une autre piste suggère que le SII pourrait résulter d’un déséquilibre du microbiote intestinal. Dans une nouvelle étude, des chercheurs pointent du doigt les cellules entérochromaffines, qui tapissent l’intestin et s’activent lorsqu’elles sont exposées à des agents irritants.
Une suractivation de cellules à l’origine des douleurs
Les signaux sensoriels de l’intestin sont transmis au système nerveux central par les fibres nerveuses afférentes primaires, y compris celles qui innervent la muqueuse intestinale, où ils interagissent avec les cellules épithéliales ; ces dernières comprennent des cellules entéroendocrines, qui jouent un rôle crucial dans la régulation gastro-intestinale, en particulier la motilité et la sécrétion intestinales : elles détectent divers signaux physiologiques et libèrent en conséquence des hormones et des neurotransmetteurs pour réguler l’absorption et la digestion des nutriments, la motilité, les comportements alimentaires et la perception sensorielle.
Les cellules entérochromaffines (EC) sont une sous-population extrêmement petite de cellules entéroendocrines ; elles détectent les stimuli environnementaux et endogènes capables de provoquer ou d’exacerber la douleur, y compris les irritants alimentaires, les métabolites microbiens, les agents inflammatoires, la distension mécanique et les hormones et neurotransmetteurs associés au stress. Lorsqu’elles s’activent, elles sécrètent de la sérotonine. Les chercheurs ont examiné les cellules EC de souris pour déterminer dans quelle mesure elles contribuaient à la douleur viscérale.
Leur expérience consistait à inhiber ou activer les cellules EC des rongeurs, puis à évaluer les conséquences sur l’activité, la neuroanatomie et le comportement des fibres nerveuses sensorielles du côlon. Les acides gras à chaîne courte d’origine bactérienne sont des activateurs connus des cellules entéroendocrines ; les cellules EC ont donc été activées en enduisant l’intestin des souris d’isovalérate. Les chercheurs ont ensuite effectué une série de distensions colorectales (pour simuler des gaz intestinaux et des ballonnements), puis ont comparé le comportement des animaux traités à l’isovalérate à celui des animaux témoins face à la douleur occasionnée.
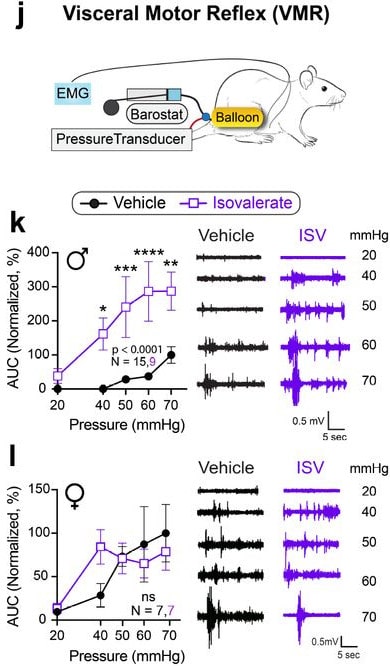
L’équipe a pu observer que les souris mâles ayant reçu de l’isovalérate étaient beaucoup plus sensibles aux distensions (ils se recroquevillaient plus souvent sous l’effet des contractions abdominales) que les mâles dont l’intestin n’avait pas été enduit de cet acide gras. Dans le cas des souris femelles, en revanche, toutes affichaient la même hypersensibilité, qu’elles aient été exposées ou non à l’isovalérate.
Une cible thérapeutique pertinente
Parallèlement, les chercheurs ont confirmé que l’effet sensibilisant de l’isovalérate était bel et bien médié spécifiquement par les cellules EC : inhiber chimiquement l’activité de ces cellules diminuait la réponse des nerfs sensoriels à la stimulation mécanique de la muqueuse. « Inhiber l’activité des cellules EC a un effet proportionnellement plus important chez les femelles. Ceci, et la plus grande sensibilité des mâles à l’isovalérate, suggèrent que les cellules EC des femelles ont une activité de base plus élevée », soulignent les chercheurs dans leur étude. Ce qui expliquerait pourquoi le SII touche majoritairement les femmes.
Après avoir montré que la stimulation des cellules EC est suffisante pour produire une hypersensibilité viscérale aiguë, les chercheurs ont vérifié si les douleurs chroniques observées dans le cas du SII pouvaient être dues à une activation prolongée des cellules EC. Après avoir administré aux souris pendant trois semaines une substance activant les cellules EC, ils ont évalué leur sensibilité à la distension colorectale 72 heures après l’arrêt de ce « traitement ». Résultat : ces souris sont restées beaucoup plus sensibles que les souris témoins.
En d’autres termes, les cellules EC peuvent rester actives même lorsque les agents irritants ont quitté l’intestin — ce qui pourrait notamment expliquer pourquoi les troubles gastro-intestinaux chroniques se développent souvent après une intoxication alimentaire ou des infections. Reste à savoir combien de temps dure cette hypersensibilité après retrait de la substance irritante, ce que l’équipe n’a pas encore déterminé.
En attendant, ces résultats suggèrent que l’activation chronique des cellules EC est, à elle seule, suffisante pour générer une hypersensibilité viscérale aiguë et persistante et ont permis d’élucider en partie la disparité sexuelle observée dans le SII. Ces cellules intestinales pourraient donc constituer une nouvelle cible thérapeutique pertinente pour traiter la douleur viscérale chronique.


