Lors d’une crise cardiaque, des millions de cellules du cœur (les cardiomyocytes) meurent, par manque d’oxygène. Ces pertes sont malheureusement irréversibles, ces cellules n’ayant pas la possibilité de se régénérer. Selon la gravité de cette dégradation, le risque d’insuffisance cardiaque et d’autres troubles cardiaques peut par la suite être très élevé. Des chercheurs ont cependant trouvé un moyen innovant de réparer et de régénérer les cellules lésées.
Si le cœur a perdu trop de cardiomyocytes, il finit par s’épuiser et n’assure plus (ou mal) sa fonction de pompe : c’est l’insuffisance cardiaque. Il n’existe cependant aucun médicament à ce jour qui permette de restaurer la fonction cardiaque ; la transplantation reste la seule option, mais la faible disponibilité de cœurs de donneurs et le risque de rejet limitent son utilisation généralisée. Ainsi, depuis des décennies, les scientifiques tentent de trouver le moyen de régénérer les cellules cardiaques.
Plusieurs équipes misent sur l’utilisation de cellules souches, qui pourraient être différenciées en cardiomyocytes. Mais cette approche pose certains problèmes : l’usage des cellules souches embryonnaires et des cellules souches pluripotentes induites est notamment associé à un risque de formation de tératome (un type de tumeur). Une équipe de l’Université de Houston s’est quant à elle intéressée au facteur de réponse sérique (SRF), qui joue un rôle majeur dans la régulation du cycle cellulaire en contrôlant la transcription de nombreux gènes.
Un état proche de celui des cellules souches
Le cœur est le premier organe fonctionnel qui se développe au cours de l’embryogenèse et le SFR est nécessaire à la formation des sarcomères — les unités de base des myofibrilles du muscle cardiaque — et au premier battement cardiaque.
Les chercheurs ont généré une série de protéines SRF mutées, qui permettent la réintégration des myocytes adultes dans le cycle cellulaire. « Ce que nous essayons de faire, c’est de dédifférencier les cardiomyocytes pour les faire passer à un état plus proche de celui des cellules souches, afin qu’ils puissent se régénérer et proliférer », explique Siyu Xiao, du Département de biologie de l’Université de Houston. Pour délivrer ces facteurs de transcription aux cellules cardiaques, l’équipe a utilisé de l’ARNm synthétique — la même technologie que celle utilisée pour les vaccins anti-COVID-19, qui consiste à inciter les ribosomes cellulaires à produire certaines protéines.
L’une de ces protéines mutées, considérée comme la plus puissante, a été baptisée STEMIN. Testé sur des cultures de myocytes de rat, l’ARN messager synthétique de STEMIN a favorisé une reprogrammation partielle vers un état de type souche et provoqué la dédifférenciation des cardiomyocytes. Une autre protéine SRF mutée, baptisée YAP5SA, dirige quant à elle une myriade de facteurs de croissance pour faire proliférer les myocytes dédifférenciés.
L’équipe a injecté de l’ARNm de STEMIN et de YAP5SA, individuellement puis en combinaison, directement dans les ventricules gauches de souris adultes vivantes ayant subi un infarctus du myocarde. L’objectif étant de vérifier si ce « traitement » permettrait de reprogrammer les myocytes pour qu’ils entrent dans le cycle cellulaire et donc, de réparer les cœurs endommagés. « Les résultats ont été stupéfiants », a déclaré Robert Schwartz, qui a co-dirigé l’étude avec Xiao.
Des cœurs réparés en l’espace d’une journée
La combinaison des deux ARNm s’est avérée particulièrement efficace pour restaurer la fonction cardiaque — bien plus que chaque ARNm pris individuellement. Après l’injection de ces facteurs de transcription dans le cœur des souris, les noyaux des myocytes se sont répliqués au moins 15 fois (et jusqu’à plus de 17 fois) en 24 heures ! « Le laboratoire a constaté que les myocytes cardiaques se multipliaient rapidement en l’espace d’une journée, tandis que les cœurs étaient réparés au cours du mois suivant pour retrouver une fonction de pompage cardiaque proche de la normale, avec peu de cicatrices », relate Schwartz.
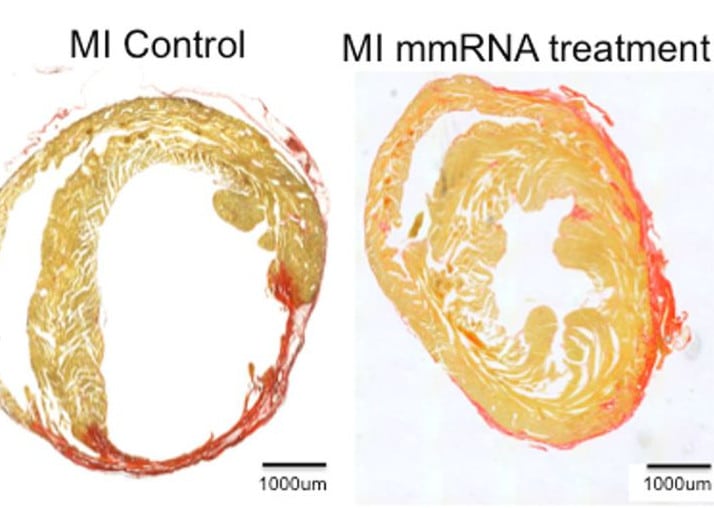


« STEMIN et YAP5SA ont favorisé la prolifération des cardiomyocytes en inhibant la différenciation des cardiomyocytes dépendant du SRF, poussant ainsi les cardiomyocytes à un stade plus primitif pour favoriser la réplication cellulaire », résument les chercheurs dans The Journal of Cardiovascular Aging. Cette approche inédite a non seulement permis de réparer les cellules du muscle cardiaque chez la souris, mais aussi de les régénérer après un infarctus. « Personne n’a été capable de le faire à ce point et nous pensons que cela pourrait devenir un traitement possible pour les humains », souligne Schwartz.
Un avantage supplémentaire de l’utilisation de l’ARNm synthétique comme véhicule de délivrance, selon Xiao, est qu’il disparaît de lui-même en quelques jours, contrairement à la livraison virale. Les thérapies géniques délivrées aux cellules par des vecteurs viraux soulèvent en effet plusieurs problèmes de biosécurité, car elles ne peuvent pas être facilement stoppées. « La délivrance par l’adénovirus de facteurs de cellules souches est initialement curative pour régénérer la fonction cardiaque, mais elle provoque à long terme des rhadomyosarcomes cardiaques », précise l’équipe.
À noter que cette méthode de délivrance de gènes basée sur l’ARNm permet également de livrer des combinaisons de gènes avec différents ratios, permettant de personnaliser le traitement pour chaque patient selon l’évolution de la maladie.