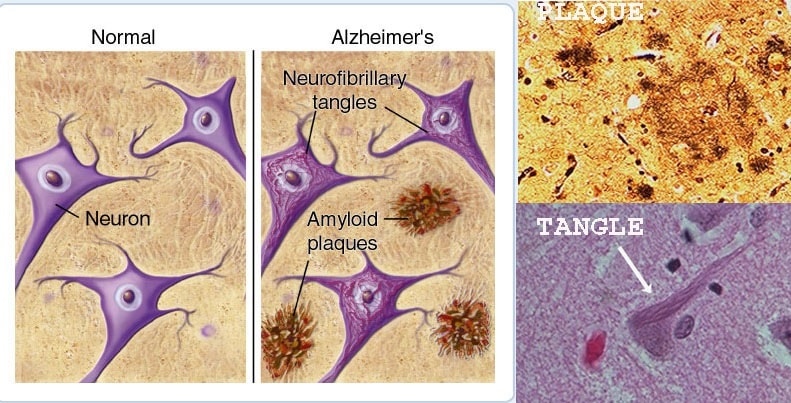
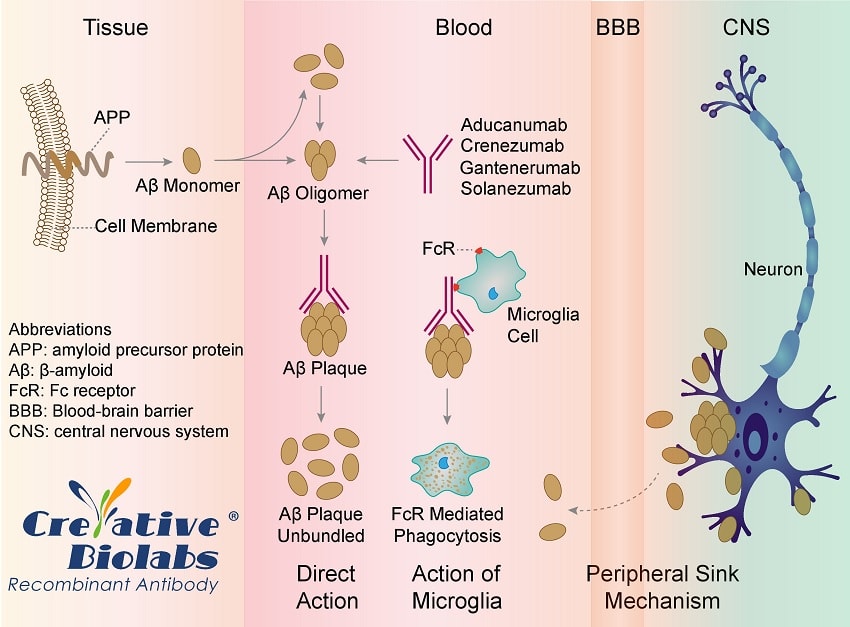
En mars 2019, l’entreprise biopharmaceutique Biogen arrêtait les essais cliniques concernant une nouvelle molécule utilisée dans le traitement de la maladie d’Alzheimer : l’aducanumab. Ce médicament, qualifié de révolutionnaire au moment de sa présentation, cible directement les dépôts amyloïdes responsables — en partie — de la maladie. Il représentait ainsi un véritable espoir pour les millions de malades à travers le monde, et l’arrêt de son développement, pour des raisons apparentes d’inefficacité, a été un choc pour tous les patients. Cependant, en réanalysant les données issues des deux essais cliniques, les chercheurs de Biogen ont remarqué qu’à forte dose, l’aducanumab ralentissait bien la progression de la maladie. Un retournement plein d’espoir qui devrait ramener le médicament en phase d’essai.
La société a déclaré qu’une nouvelle analyse d’un ensemble de données plus vaste avait montré que le médicament, l’aducanumab, réduisait le déclin clinique chez les patients atteints de la maladie d’Alzheimer au stade précoce, grâce à plusieurs mesures de l’efficacité du médicament. Cela contredit directement la décision prise en mars d’arrêter les études sur le traitement sur la base des recommandations d’un conseil de surveillance indépendant chargé de protéger les patients participant à l’étude.
L’arrêt de l’Aducanumab a envoyé des ondes de choc bien au-delà de Biogen. On pensait que c’était le dernier d’une série de médicaments — les précédents ayant tous échoué — ciblant une protéine du cerveau appelée bêta-amyloïde. Après l’annonce de Biogen en mars, la plupart des chercheurs n’avaient que peu d’espoir de retrouver un médicament qui aiderait les patients atteints de la maladie d’Alzheimer en ciblant directement les dépôts amyloïdes.
Biogen a expliqué avoir mené une nouvelle analyse, en consultation avec la FDA, d’un ensemble de données plus vaste issu des études abandonnées. La nouvelle analyse inclut des données supplémentaires qui sont devenues disponibles après que la précédente a montré que les études étaient « futiles », c’est-à-dire qu’elles n’avaient aucune chance de réussir.
Aducanumab : une nouvelle analyse montre qu’il est véritablement efficace
Les nouvelles données montrent que l’aducanumab est « pharmacologiquement et cliniquement actif » et qu’il a permis de réduire le déclin clinique des patients, d’après les résultats d’une enquête intitulée « Clinical Dementia Rating-Sum of Boxes (CDR-SB) », ce qui était l’objectif principal des deux études.
« Avec une maladie aussi dévastatrice qui touche des dizaines de millions de personnes dans le monde, l’annonce faite aujourd’hui est vraiment encourageante dans la lutte contre la maladie d’Alzheimer. Cela est le résultat de recherches novatrices et témoigne de la détermination inébranlable de Biogen de suivre la science et de faire ce qu’il faut pour les patients » déclare Michel Vounatsos, directeur général de Biogen.
« Nous sommes optimistes quant à la possibilité d’offrir aux patients le premier traitement permettant de réduire le déclin clinique de la maladie d’Alzheimer et quant aux implications potentielles de ces résultats pour des approches similaires ciblant la bêta-amyloïde » ajoute Vounatsos.
Al Sandrock, responsable de la recherche et du développement chez Biogen, a déclaré lors de son premier entretien au sujet des nouveaux résultats que son équipe n’a découvert qu’un cas précédent où un essai avait été arrêté pour cause d’échec, et qui s’était ensuite avéré positif.
« J’ai encore des difficultés à y croire.. C’est tellement incroyable d’assister à ce retournement de situation biomédicale. Mais je suis aussi très très heureux parce que je connais des personnes atteintes de troubles cognitifs légers, et j’avais l’impression de les avoir toutes laissées tomber » déclare Sandrock.
Une analyse d’échec intervenue trop tôt et sur des données incomplètes
Dès juin, alors que Biogen analysait l’ensemble des données, les chercheurs ont commencé à se rendre compte qu’une situation différente concernant l’aducanumab était en train d’émerger. La raison en était la cause des changements que Biogen avait apportés à l’étude en fin d’essai. Au début, la société s’inquiétait d’un éventuel effet indésirable — l’inflammation du cerveau — et limitait la posologie du médicament. Mais plus tard, les patients ont été autorisés à recevoir des doses plus élevées du médicament.
« Rétrospectivement, les résultats de l’analyse d’échec étaient incorrects, car elle provenait d’un petit jeu de données concernant des patients moins exposés à l’aducanumab à forte dose » explique Sandrock. En substance, l’analyse d’échec est intervenue trop tôt. Elle avait examiné les données basées sur décembre dernier. Mais les essais ont été arrêtés en mars.
Biogen avait mené deux études. L’une d’elle était positive pour la dose élevée. La seconde a échoué, mais montrait des signes de bénéfice chez les patients qui ont reçu la dose la plus élevée d’aducanumab.
La situation est très inhabituelle et Sandrock a déclaré que ce serait à la FDA de décider d’approuver ou non le médicament sur la base d’un seul essai positif. Mais il a ajouté que Biogen avait rencontré la FDA à deux reprises pour discuter de sa décision, d’abord en juin puis de nouveau lundi. Il a ajouté que la FDA avait fourni des commentaires écrits préliminaires, qui avaient amené Biogen à déposer son dossier pour approbation.
Sur le même sujet : Un essai clinique inverse une année d’effets de la maladie d’Alzheimer en seulement 2 mois
Levée de fonds instantanée à Wall Street
Sandrock a également partagé discrètement les données avec des experts externes. « Les gens ont un scepticisme initial. À juste titre. Mais ensuite, lorsque nous commençons à leur montrer les données et qu’ils les consultent, la plupart d’entre eux sont très enthousiastes car ils se rendent compte maintenant que le médicament pourrait être approuvé ».
Biogen a présenté les nouvelles données de son essai sur Alzheimer lors d’une téléconférence avec les analystes de Wall Street, qui s’attaquaient au revirement de la société et à des informations complexes et quelque peu contradictoires. Umer Raffat, analyste à la banque d’investissement Evercore/ISI, a d’abord demandé si le départ de Michael Ehlers, ancien directeur de la recherche et du développement de Biogen, avait un lien quelconque avec les désaccords sur l’ensemble des données des essais cliniques.
Vounatsos, le PDG de Biogen, a déclaré que le départ d’Ehlers était personnel, ce qui impliquait que le désaccord sur les données ne jouait aucun rôle. Raffat a également demandé si, d’une certaine manière, un essai avait réussi et qu’un autre avait échoué. Les données dans les groupes à faible dose étaient cohérentes dans tous les essais. Pourquoi devrait-il y avoir confiance dans un résultat qui n’est apparu que dans une seule étude ?
Jusqu’à 23% de déclin cognitif en moins
Dans une étude appelée Emerge, les patients sous aducanumab à forte dose ont présenté une réduction de 23% de leur taux de déclin comparé à ceux sous placebo ; ceux qui prenaient la dose faible montraient une réduction de 11% par rapport à ceux sous placebo, mais ce résultat n’était pas statistiquement significatif. Cependant, dans le deuxième essai, nommé Engage, la diminution n’était que de 2% chez les patients recevant la dose élevée. Biogen a déclaré que les patients d’Emerge avaient reçu des doses plus élevées en raison de modifications apportées tardivement aux études.
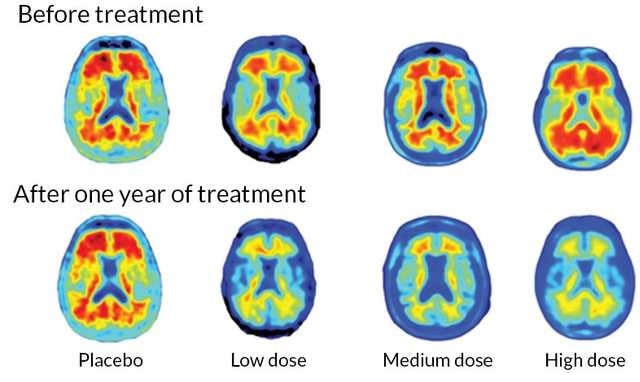


Mais Biogen a divulgué des données chez les patients ayant terminé l’étude, ainsi que chez tous les patients. Raffat a noté que les patients qui n’avaient pas terminé leur traitement semblaient également présenter des avantages. Il a qualifié cela de déroutant dans une note adressée aux investisseurs à la suite de la conversation. Dans l’intervalle, Biogen mettra le médicament à la disposition des patients précédemment recrutés pour ses essais cliniques.


