Une récente étude suggère que de courts brins d’ARN toxiques sont impliqués dans l’autodestruction des neurones dans la maladie d’Alzheimer, par le biais d’un processus appelé « interférence d’ARN ». Ces brins ont notamment été retrouvés à des quantités anormalement élevées dans le cerveau de patients Alzheimer, ainsi que dans le cerveau d’individus âgés. Cette découverte pourrait ouvrir la voie à de nouvelles approches thérapeutiques, qui pourraient même s’étendre à d’autres maladies neurodégénératives.
Selon l’hypothèse conventionnelle, Alzheimer est une maladie neurodégénérative provoquée par une succession d’événements appelée « cascade amyloïde ». Elle est notamment caractérisée par l’accumulation de plaques bêta-amyloïdes et l’enchevêtrement de protéines tau, conduisant progressivement à la perte des neurones. Cependant, cette théorie est depuis peu remise en question et la chaîne d’événements exacte conduisant à la mort des neurones est à ce jour encore difficile à identifier.
Malgré le manque de précision dans la physiopathologie de la maladie, 70 à 80 % des efforts visant à la traiter se concentrent sur la réduction des plaques amyloïdes. Toutefois, les traitements basés sur cette stratégie manquent d’efficacité et ne permettent que de ralentir légèrement la progression de la maladie. Cela a amené à l’exploration de nouvelles approches et de cibles thérapeutiques potentielles.
Il a récemment été suggéré que les dommages à l’ADN associés au vieillissement provoqueraient une accumulation d’altérations somatiques chez les personnes souffrant d’Alzheimer. Toutes les informations génétiques nécessaires à nos fonctions biologiques étant stockées dans l’ADN… Pour transformer ces informations génétiques en éléments constitutifs de la vie, l’ADN doit être converti en ARN, qui est utilisé par la machinerie cellulaire pour produire des protéines.
Mis à part les ARN codants pour des protéines, il existe des versions plus courtes (d’ARNs) non codants et assurant d’autres fonctions essentielles. Parmi ces fonctions figure l’interférence d’ARN, entraînant la désactivation des protéines pour lesquelles les ARN « longs » codent. Il s’agit entre autres d’une forme de régulation post-transcriptionnelle régulant négativement l’expression des gènes au niveau de l’ARN codant.
Des chercheurs de l’Université Northwestern aux États-Unis ont suggéré que l’interférence ARN pourrait être impliquée dans l’étiologie d’Alzheimer. Dans le cadre de leur nouvelle étude publiée dans la revue Nature Communications, ils ont notamment identifié des ARNs toxiques induisant des dommages à l’ADN, entraînant la perte neuronale chez les patients Alzheimer et chez les personnes âgées. En temps normal, ces brins sont régulés par des ARNs dits « protecteurs ».
« Personne n’a jamais relié les activités des ARN à la maladie d’Alzheimer », a déclaré dans un communiqué l’auteur correspondant de l’étude, Marcus Peter, de l’Université Northwestern. « Nous avons constaté que dans les cellules cérébrales vieillissantes, l’équilibre entre les ARNs toxiques et protecteurs migre vers les ARNs toxiques », a-t-il expliqué.
Un déséquilibre entre ARNs protecteurs et toxiques
Les micro-ARNs (un type d’ARN) assurent plusieurs fonctions régulatrices au niveau des cellules et veillent à leur survie en jouant un rôle de protection. Ils sont en effet des sortes de gardiens empêchant les ARNs toxiques d’induire des interférences d’ARN susceptibles de nuire à la cellule.
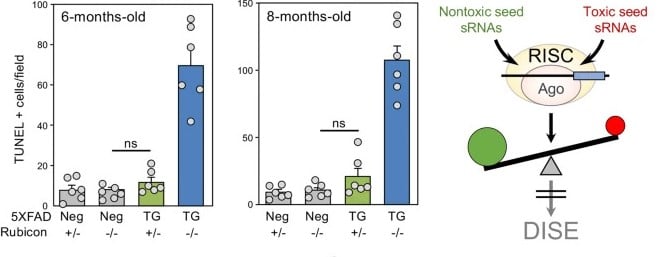
Au cours de leur étude, Peter et ses collègues ont en effet identifié des séquences ARN pouvant détruire les cellules en bloquant la production de protéines essentielles à leur survie. Il s’agit d’un processus appelé « mort induite par élimination des gènes de survie » (Death Induced by Survival Gene Elimination, ou DISE), impliqué dans l’élimination des cellules tumorales. Les chercheurs ont suggéré qu’il pourrait également induire la perte des neurones dans la maladie d’Alzheimer.
Afin de tester leur hypothèse, les experts ont analysé le comportement de l’ARN dans le cerveau de modèles murins d’Alzheimer, dans le cerveau de souris jeunes et âgées, dans les neurones dérivés de cellules souches pluripotentes induites provenant d’individus en bonne santé (jeunes et âgés) et de patients souffrant d’Alzheimer. De multiples lignées cellulaires de type neurone dérivées du cerveau humain et traitées avec des fragments de bêta-amyloïdes ont également été analysées. Les cerveaux d’un groupe de « superaînés » âgés d’au moins 80 ans ont aussi été examinés. Il s’agit de personnes âgées dont la capacité de mémoire est équivalente à celle d’individus de 20 à 30 ans plus jeunes.
Les chercheurs ont constaté une corrélation étroite entre la DISE, les dommages à l’ADN et la perte neuronale dans la maladie d’Alzheimer et le vieillissement. Les niveaux d’ARNs protecteurs étaient notamment significativement réduits dans les modèles de la maladie et de vieillissement. En revanche, les données ont révélé que les cerveaux des superaînés présentaient des niveaux nettement plus élevés de microARNs protecteurs. Ces résultats suggèrent qu’un faible taux de ces ARNs dans le cerveau vieillissant permet aux ARNs toxiques d’envahir les neurones et d’induire des interférences.


Par ailleurs, « nos données fournissent une nouvelle explication de la raison pour laquelle, dans presque toutes les maladies neurodégénératives, les individus affectés vivent des décennies sans (ou avec peu de) symptômes, puis la maladie s’installe progressivement à mesure que les cellules perdent leur protection avec l’âge », suggère Peter. Il est également intéressant de noter que les patients Alzheimer présentent une prévalence du cancer étonnamment faible par rapport à la moyenne — ce qui concorde avec l’hypothèse de la suractivation de la DISE.
D’un autre côté, les expériences in vitro ont montré que les cellules exposées à la protéine amyloïde présentaient plus de dommages à l’ADN, associés à l’interférence induite par l’ARN toxique. En augmentant la quantité d’ARNs protecteurs, ces neurones semblaient moins vulnérables aux dommages à l’ADN. En outre, l’amélioration de l’activité protéinique visant à augmenter le taux de microARNs protecteurs a complètement mis fin au mécanisme d’endommagement de l’ADN et a partiellement inhibé la DISE.
Ces résultats suggèrent que l’augmentation des niveaux de microARNs protecteurs pourrait constituer une nouvelle approche thérapeutique, à la fois pour Alzheimer et pour d’autres maladies neurodégénératives. La prochaine étape de recherche consiste à explorer cette voie et à identifier les meilleurs composés permettant d’augmenter sélectivement les niveaux d’ARNs protecteurs ou de bloquer leurs homologues ARNs.