KJ Muldoon, aujourd’hui âgé de dix mois, est devenu le premier patient au monde à recevoir une thérapie génique CRISPR personnalisée pour traiter un déficit sévère en carbamoyl phosphate synthétase 1 (CPS-1), une affection génétique extrêmement rare. Administrée en février dernier, la thérapie a corrigé avec succès la mutation spécifique à la maladie, sans effets secondaires observés à ce jour. Les chercheurs espèrent que cette approche pourra, à terme, être déclinée pour d’autres maladies génétiques rares.
La technique CRISPR (acronyme de « Clustered Regularly Interspaced Short Palindromic Repeats »), qui permet une édition précise du génome, offre la possibilité de corriger directement les variants pathogènes responsables de nombreuses maladies génétiques. En théorie, cet outil moléculaire pourrait s’attaquer à la grande majorité des affections liées à des mutations génétiques. Selon certaines estimations, la technologie CRISPR-Cas9 pourrait permettre de traiter plus de 90 % des variantes pathogènes identifiées dans les maladies héréditaires.
Jusqu’à présent, cette technologie révolutionnaire n’a été utilisée que pour des pathologies génétiques relativement fréquentes, telles que la drépanocytose, la β-thalassémie ou encore l’angio-œdème héréditaire, en raison de la complexité technique qu’elle implique. Adapter CRISPR à des maladies plus rares requiert en effet des ressources considérables, tant humaines que financières.
Par ailleurs, la diversité des mutations responsables d’une même pathologie complique l’élaboration de traitements universels par édition génétique. L’approche mise au point pour le jeune KJ Muldoon pourrait être la première du genre à offrir un cadre adaptable à d’autres patients atteints de maladies génétiques ultra-rares.
« Des années de progrès en édition génétique, ainsi qu’une collaboration étroite entre chercheurs et cliniciens, ont rendu ce moment possible. Et bien que KJ ne soit qu’un premier patient, nous espérons qu’il sera le précurseur d’une nouvelle génération de traitements sur mesure, adaptés aux mutations propres à chaque individu », explique dans un communiqué Rebecca Ahrens-Nicklas, directrice du programme Frontier de thérapie génique pour les troubles métaboliques héréditaires (GTIMD) à l’Hôpital pour enfants de Philadelphie et professeure adjointe de pédiatrie à la Perelman School of Medicine de l’Université de Pennsylvanie.
« C’est véritablement l’avenir de toutes les thérapies géniques et cellulaires », ajoute, dans un article publié dans la revue Nature, Arkasubhra Ghosh, spécialiste en thérapie génique à l’hôpital ophtalmologique Narayana Nethralaya de Bengaluru (Inde), qui n’a pas pris part à cette recherche.
Un espoir thérapeutique pour les plus jeunes patients
KJ n’avait que quelques jours lorsqu’un déficit sévère en CPS-1 lui a été diagnostiqué. Cette enzyme joue un rôle essentiel dans le métabolisme de l’azote, issu de la dégradation des protéines. L’enfant a hérité de la mutation causale de chacun de ses parents. Ce déficit enzymatique provoque une accumulation d’ammoniac dans le sang, substance toxique lorsqu’elle n’est pas éliminée.
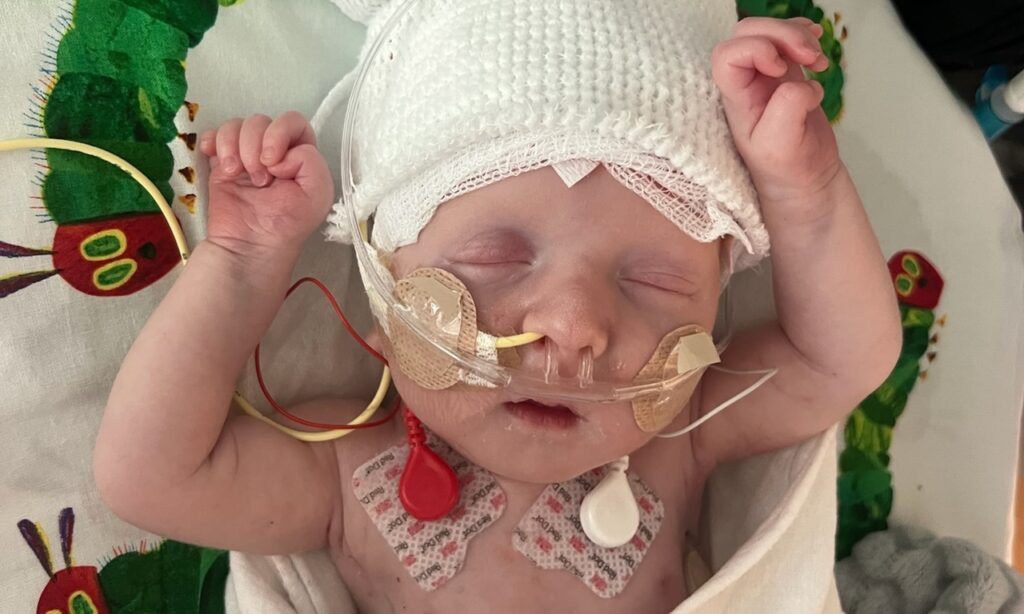
Chez l’humain, l’ammoniac est produit naturellement lors de la digestion des protéines, puis transformé en urée, évacuée ensuite dans les urines. En l’absence de l’enzyme CPS-1, cette conversion ne peut s’opérer, entraînant une accumulation d’ammoniac dans l’organisme, avec un risque de lésions graves, voire mortelles, au niveau du foie et du cerveau.
Actuellement, la transplantation hépatique constitue la principale alternative thérapeutique. Mais celle-ci ne peut être envisagée que lorsque l’enfant atteint un âge et un état de santé compatibles avec une telle intervention. Or, dans l’intervalle, les concentrations d’ammoniac dans le sang continuent de croître, et la plupart des jeunes patients ne survivent pas assez longtemps pour recevoir une greffe — la mortalité infantile avoisinant 50 %.
Les thérapies géniques pourraient changer radicalement la donne. L’équipe dirigée par Rebecca Ahrens-Nicklas, après avoir mené des essais précliniques sur plusieurs variants pathogènes similaires, a pu identifier, peu avant la naissance de KJ, une mutation spécifique du gène CPS1 le concernant. Cela a permis de développer une thérapie d’édition de bases sur mesure pour l’enfant, administrée au foie via des nanoparticules lipidiques conçues pour corriger le gène défectueux.
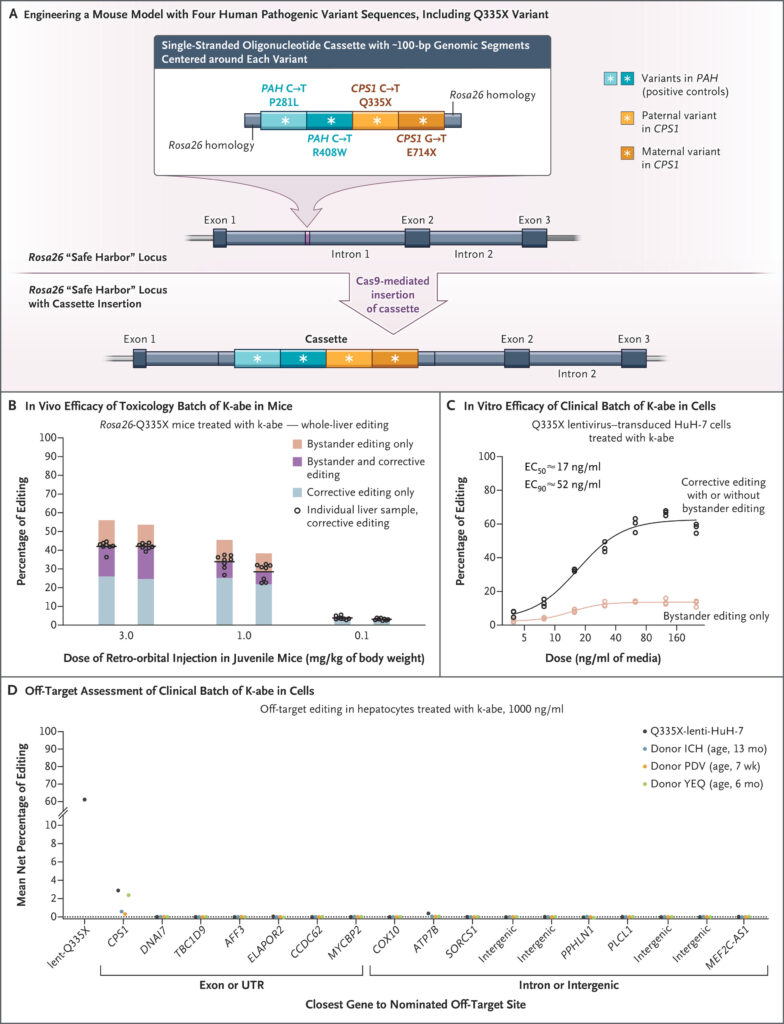


Le traitement a bénéficié d’un développement accéléré grâce au soutien coordonné d’institutions universitaires, d’acteurs privés et de la Food and Drug Administration (FDA) américaine. Avant la thérapie, KJ a passé ses premiers mois à l’hôpital, nourri selon un régime alimentaire extrêmement restrictif, complété de médicaments destinés à piéger l’azote en excès. Il a reçu une première dose du traitement CRISPR en février 2025, alors qu’il avait entre six et sept mois. Deux autres injections ont suivi en mars puis en avril.
Selon les résultats publiés dans le New England Journal of Medicine, l’enfant se porte bien et ne présente, à ce jour, aucun effet secondaire. Il tolère désormais une augmentation progressive de ses apports en protéines, et ses besoins en médicaments piégeurs d’azote ont pu être significativement réduits. Il est même parvenu à surmonter des infections virales bénignes, telles qu’un rhume provoqué par un rhinovirus.
Les chercheurs restent toutefois prudents : évoquer une guérison serait, à ce stade, prématuré. Un suivi de longue durée est indispensable pour évaluer pleinement l’efficacité et l’innocuité du traitement. « Bien que KJ doive être suivi avec attention tout au long de sa vie, nos premières observations sont encourageantes », souligne Ahrens-Nicklas. « La promesse de la thérapie génique, dont nous entendons parler depuis des décennies, se concrétise et va révolutionner notre approche de la médecine », conclut son collègue, Kiran Musunuru, de l’Hôpital pour enfants de Philadelphie et de la Perelman School of Medicine.


