Au cours de la dernière décennie, l’intérêt pour le développement de biorobots — de minuscules machines construites à partir de tissus biologiques — a connu une augmentation rapide. Et pour cause : les applications humaines potentielles sont multiples, de la production d’insuline à la réparation des lésions de la moelle épinière. Une équipe de chercheurs américains annonce avoir réussi à concevoir des biorobots fabriqués à partir de cellules humaines, favorisant la guérison de tissu nerveux.
En 2020, des chercheurs de l’Université Tufts et de l’Université du Vermont ont créé pour la première fois de minuscules robots biologiques à partir de cellules de peau de grenouille. Ces robots, baptisés xénobots, pouvaient nager dans un liquide, pousser une charge utile, travailler ensemble et même s’autoréparer en cas de dommage. Dès l’année suivante, ils ont présenté une version améliorée de leurs xénobots : ceux-ci se déplaçaient plus rapidement, mais surtout, étaient capables de s’autorépliquer à partir de cellules individuelles.
La capacité de fabriquer une construction vivante multicellulaire autopropulsée, avec une structure corporelle et un comportement différents de l’espèce par défaut, est-elle limitée aux tissus embryonnaires d’amphibiens ? Pour le vérifier, la même équipe a cette fois-ci conçu une nouvelle forme de biorobots, à partir de cellules épithéliales bronchiques humaines — l’objectif étant de développer des robots qui soient plus compatibles avec l’organisme humain, pour les futures applications médicales potentielles.
Des « ponts » de biorobots qui favorisent la cicatrisation
Ces minuscules machines, appelées anthrobots, sont des robots biologiques multicellulaires de forme sphéroïde, dont le diamètre varie de 30 à 500 micromètres. Grâce aux cils qui recouvrent leur surface, ils sont capables de se déplacer en milieu aqueux, à des vitesses allant de 5 à 50 μm/s. « Chaque anthrobot est au départ une cellule unique, dérivée d’un poumon humain adulte, qui se transforme en une machine biologique multicellulaire mobile après avoir été cultivée dans une matrice extracellulaire pendant deux semaines », expliquent les chercheurs. Une fois formés, les anthrobots peuvent survivre quatre à six semaines (dans des conditions de laboratoire) ; ils sont totalement biodégradables.
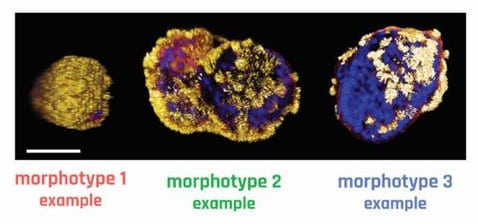
Les anthrobots peuvent adopter diverses morphologies (les chercheurs ont identifié trois morphotypes principaux), allant de corps petits ou plus gros, présentant une couverture de cils plus ou moins polarisée, de forme sphérique ou ellipsoïdale, chacune étant corrélée à un type de mouvement distinct (circulaire, linéaire, curviligne et éclectique). Ces robots peuvent ainsi suivre plusieurs schémas de motilité et de ce fait, sont capables de traverser des tissus humains vivants de diverses manières.
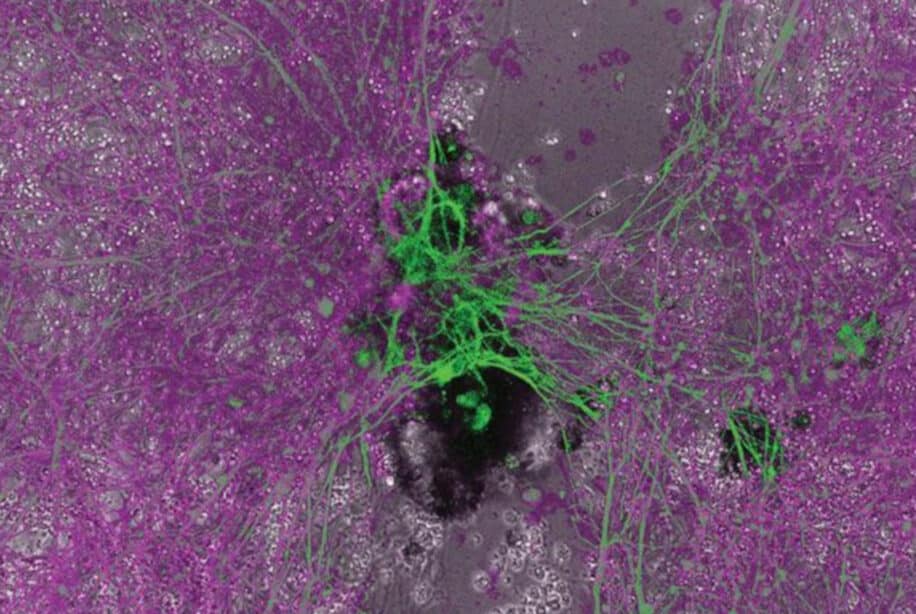
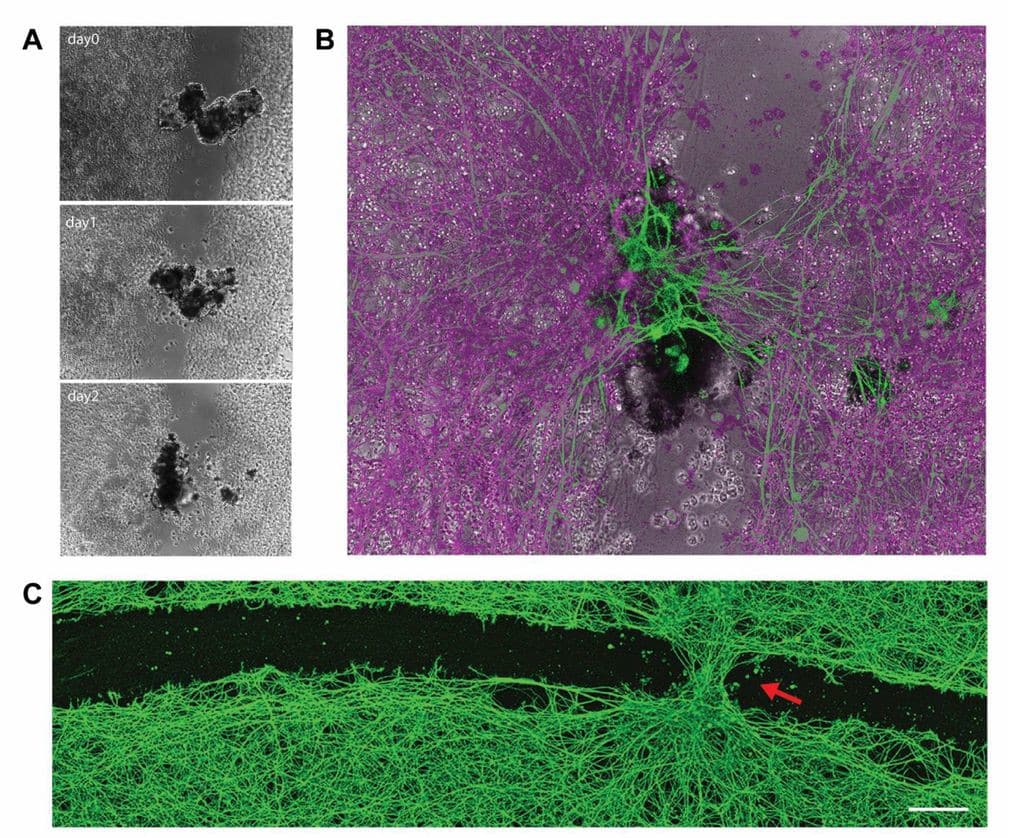
Mais ce n’est pas tout : les anthrobots présentent un comportement complètement inattendu compte tenu de leur origine en tant qu’épithélium trachéal statique ; ils peuvent traverser des plaies dans le tissu neural humain ! À partir de ce constat, les chercheurs ont souhaité vérifier comment ces robots se comportaient en présence d’autres cellules. Dans une expérience réalisée en laboratoire, le biologiste Michael Levin et ses collègues ont tout d’abord réuni plusieurs anthrobots dans un espace restreint, afin de faciliter leur agrégation et obtenir des « superbots ».
Ils ont ensuite placé ces superbots sur quelques sites d’un tissu vivant lésé, formé de cellules neuronales humaines, de manière à ce qu’ils couvrent toute la largeur de la blessure. Le résultat était surprenant : « Dans les 72 heures qui ont suivi l’inoculation des superbots dans la déchirure tissulaire, nous avons observé une repousse substantielle du tissu natif en cours, entraînant la formation d’un point juste sous les « ponts superbots », reliant les deux côtés de la cicatrice », décrit l’équipe dans son article de préimpression.
Un matériel cellulaire au potentiel sous-estimé
À noter que cette cicatrisation a été observée uniquement sur les sites d’inoculation des superbots et à aucun autre endroit de la lésion, ce qui suggère que les assemblages d’anthrobots induisent une guérison efficace de tissu nerveux vivant.


« La capacité des cellules humaines adultes, somatiques, à former une nouvelle anatomie fonctionnelle, avec des comportements uniques, révèle que cette plasticité ne se limite pas aux propriétés des cellules amphibiennes ou embryonnaires, et est une caractéristique fondamentale des cellules de type sauvage qui ne nécessite aucune manipulation génétique directe pour être déverrouillée », souligne l’équipe. En d’autres termes, il apparaît aujourd’hui que le génome humain code pour du matériel cellulaire ayant un potentiel morphogénétique, comportemental et fonctionnel qui va bien au-delà de ce que l’on observe habituellement in vivo — ce qui ouvre la voie à toute une gamme d’applications biomédicales.
De nombreuses utilisations in vitro et in vivo de telles machines vivantes sont en effet envisageables, notamment parce qu’elles peuvent désormais être constituées des propres cellules du patient. « Les anthrobots sont dérivés de tissus humains adultes et pourraient à l’avenir être personnalisés pour chaque patient, permettant un déploiement in vivo sûr de ces robots dans le corps humain sans provoquer d’inflammation ni déclencher de réponse immunitaire », précisent les chercheurs.
Ces robots pourraient par exemple être utilisés pour éliminer l’accumulation de plaques d’athérome chez les patients atteints d’athérosclérose, pour délivrer localement des médicaments, ou encore traiter les dommages cellulaires pouvant survenir après un AVC ou une paralysie. L’équipe envisage à présent de tenter de construire des anthrobots à partir d’autres types de cellules, d’explorer leurs comportements dans différents environnements et ainsi de découvrir potentiellement d’autres capacités utiles.