Des biorobots multicellulaires créés à partir de cellules trachéales humaines montrent de remarquables capacités réparatrices. Baptisés Anthrobots, ces structures autonomes peuvent notamment se déplacer sur de grandes distances et stimuler en toute sécurité la croissance neuronale, et ce sans qu’aucune modification génétique ne soit requise.
Chez les organismes pluricellulaires, les cellules sont dotées d’une capacité naturelle d’auto-assemblage afin de former des structures plus grandes, allant des organoïdes aux organes entiers, en passant par les tissus. « Deux différences importantes par rapport aux briques inanimées sont que les cellules peuvent communiquer entre elles et créer ces structures de manière dynamique, et chaque cellule est programmée avec de nombreuses fonctions, comme le mouvement, la sécrétion de molécules, la détection de signaux et bien plus encore », explique Gizem Goumouskaïa, de l’Université Tufts à Boston et de Harvard.
Une nouvelle étude de Goumouskaïa et ses collègues vise à tirer parti de ces capacités intrinsèques de flexibilité et d’auto-assemblage, pour former des biobots. « Nous sommes juste en train de découvrir comment combiner ces éléments pour créer de nouveaux plans et fonctions biologiques du corps, différents de ceux trouvés dans la nature », affirme Goumouskaïa.
Les biobots offriraient la possibilité d’utiliser l’ingénierie pour contrôler des microconditions cellulaires qui seraient trop difficiles à obtenir via une manipulation directe in situ. Cela permettrait notamment d’améliorer les efforts de bioingénierie visant à produire des tissus complexes, en vue d’une transplantation par exemple. D’autre part, un contrôle des propriétés collectives fonctionnelles et morphologiques des groupes de cellules permettrait de développer des biobots pouvant par exemple se faufiler à travers les artères afin d’éliminer les dépôts d’athérome, réparer des lésions nerveuses ou livrer des molécules thérapeutiques.
Des biobots capables de se déplacer sur de grandes distances
Avant les anthrobots, les premiers biobots entièrement biologiques étaient constitués de cellules embryonnaires de grenouilles, sculptées ou moulées, puis auto-assemblées sans aucune manipulation génétique. Baptisés Xenobots, les structures multicellulaires obtenues sont capables de se déplacer spontanément sans stimulation externe à travers d’étroits passages, de collecter des molécules, de collecter des informations biologiques et de réparer des lésions.
Cependant, jusqu’ici, les chercheurs ne savaient pas si ces capacités étaient généralisées ou non, entre autres si cette plasticité et cette polyvalence pouvaient s’étendre aux cellules de mammifères. Les anthrobots ont été développés dans ce sens, à partir de cellules trachéales humaines. « Nous avons cherché à déterminer si la capacité des cellules génétiquement non modifiées à générer de cette manière une structure vivante multicellulaire automotrice est unique aux cellules embryonnaires d’amphibiens, et si une telle structure vivante peut être construite sans avoir besoin d’être sculptée ou moulée individuellement, mais plutôt amenée à s’auto-construire à partir d’une cellule graine initiale », ont écrit Goumouskaïa et son équipe dans leur document d’étude, publié dans la revue Advanced Science. Cette technique pourrait permettre d’établir un processus à haut débit, dans lequel un grand nombre de biobots peuvent être cultivés en parallèle.
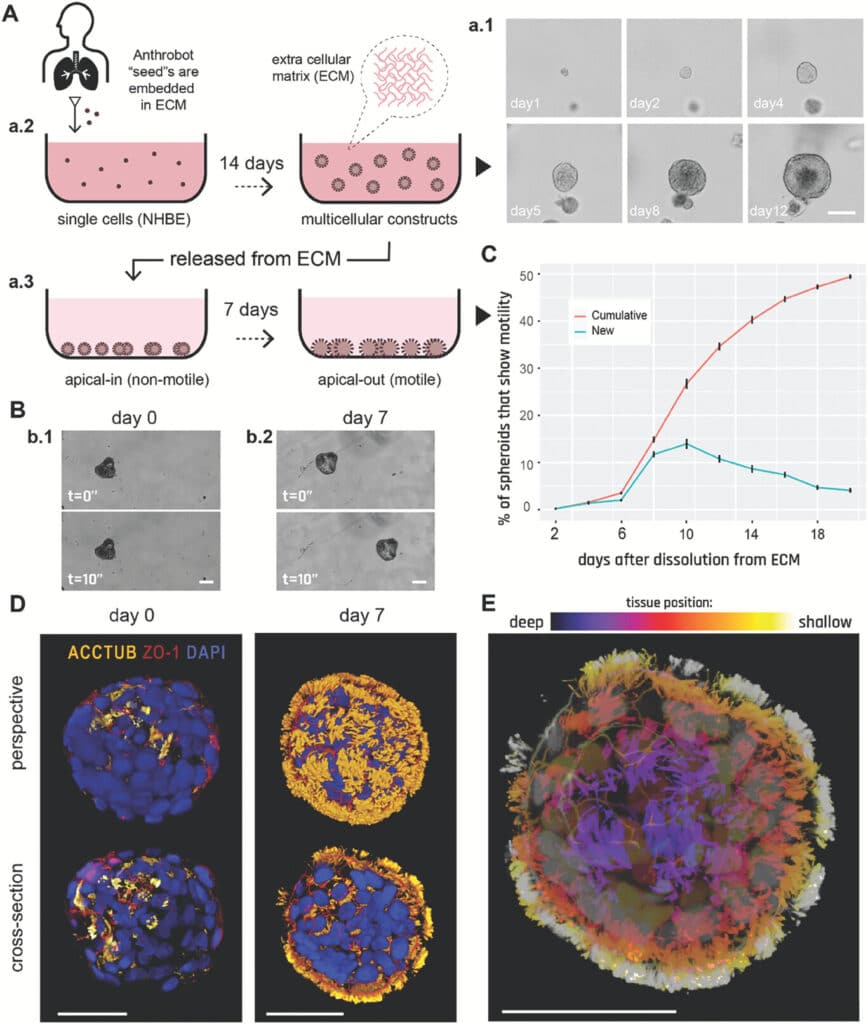
Les cellules uniques donnant naissance aux anthrobots sont issues d’un donneur adulte. Les chercheurs ont choisi particulièrement celles de la trachée en raison de leurs cils mobiles, leur permettant d’expulser les particules indésirables infiltrant les poumons et la gorge. De précédentes expériences ont également démontré leur capacité à s’auto-assembler en organoïdes sphériques lorsqu’elles sont cultivées in vitro. Des conditions de croissance spécifiques ont d’autre part été mises au point afin d’inciter les cils à pousser sur la surface externe des organoïdes, pour que ceux-ci puissent se mouvoir.
Après quelques jours de culture, les organoïdes se sont mis à se déplacer en utilisant les cils comme des rames. Les anthrobots sont également caractérisés par différents types de mouvements et de formes, allant de 30 à 500 micromètres de diamètre (soit de l’épaisseur d’un cheveu humain à la pointe d’un crayon bien taillé). Certains étaient sphériques et entièrement recouverts de cils, tandis que d’autres étaient plutôt irréguliers, avec une couverture ciliée disparate, ou simplement répartie sur un côté.
Les premiers anthrobots produits se déplaçaient en ligne droite, en cercle serré, en combinant ces deux mouvements, ou en se tortillaient tout simplement sur place (ne s’éloignant dans ce cas que très peu de l’emplacement initial). Ces derniers incluaient surtout les biobots entièrement couverts de cils, tandis que ceux dotés de cils disparates pouvaient se déplacer sur de plus grandes distances, sur des trajectoires courbes ou droites.


Des capacités réparatrices sans modifications génétiques
Afin de savoir si les anthrobots peuvent être utilisés à des fins thérapeutiques, les chercheurs ont évalué dans quelle mesure ils pouvaient migrer pour combler une lésion. Pour ce faire, une couche bidimensionnelle de neurones humains a été incisée pour créer une lésion ouverte qui a été exposée aux biobots. Afin d’assurer que la lésion soit exposée à une concentration suffisamment élevée de biobots, les chercheurs ont créé des « superbots », un rassemblement se formant naturellement lorsque des anthrobots principalement constitués de sphères entièrement ciliées sont confinés au sein d’un petit espace (afin qu’ils ne s’éloignent pas trop de la lésion).
Alors que l’on pourrait s’attendre à ce que des modifications génétiques soient nécessaires pour qu’ils stimulent la croissance neuronale, les anthrobots ont démontré une étonnante capacité à déclencher une régénération substantielle. Ils ont notamment formé des ponts de neurones aussi épais que la couche saine, tandis qu’aucun neurone ne s’est développé au niveau de la région de la lésion dépourvue d’anthrobots.
Par ailleurs, les anthrobots semblent offrir un avantage considérable par rapport aux autres biobots en matière d’innocuité. En étant cultivés à partir des cellules trachéales d’un patient, ils permettent de contourner l’obstacle du rejet immunitaire. En outre, ils ne survivent généralement qu’environ 45 à 60 jours dans des conditions de laboratoire, avant de se biodégrader naturellement. D’autre part, les chercheurs de l’étude suggèrent que d’autres caractéristiques pourraient être ajoutées, en intégrant par exemple d’autres types de cellules. De cette manière, les anthrobots pourraient être conçus pour réagir et s’adapter à leur environnement, remplir des fonctions organiques, édifier des structures tissulaires complexes, etc.