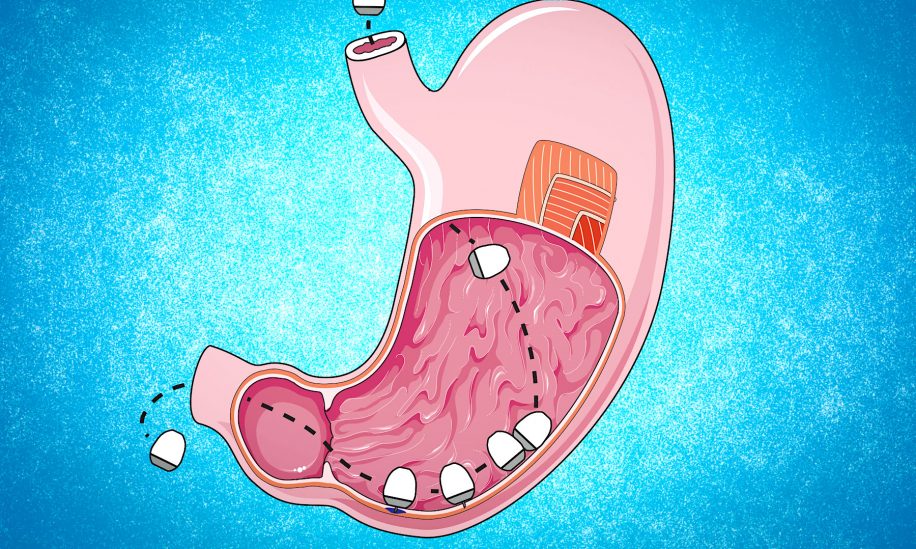
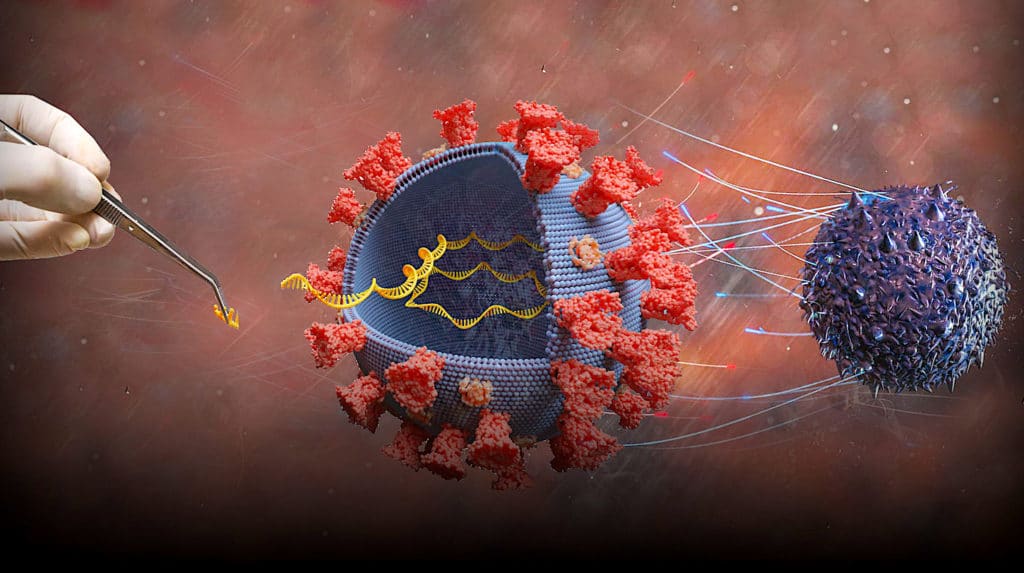
Les recherches sur les « ARN messagers » (ARNm) connaissent une véritable poussée de croissance suite à la pandémie de COVID-19. La dernière génération de chercheurs du Massachusetts Institute of Technology (MIT) a dans cet élan et une fois de plus, mis au point une petite merveille de biotechnologie : une capsule à ARNm à administration orale. Après avoir été avalée, la capsule se fixe à la paroi gastro-intestinale et libère directement la charge d’ARNm au niveau des cellules, aussi rapidement et aussi efficacement qu’une injection, ce qui ouvre la voie à de multiples possibilités de traitements.
Publiée dans le journal Matter, l’étude révèle une capsule particulièrement efficace. La gélule, de la taille d’une myrtille, possède un dôme long et raide inspiré de la tortue léopard. Tout comme cette petite tortue terrestre, elle est capable de se redresser si elle roule « sur le dos ». Le contenu peut ainsi être facilement injecté dans la muqueuse de l’estomac, grâce à des microaiguilles qui tapissent la capsule. La livraison faite, elle se détache de la paroi gastro-intestinale et s’évacue naturellement à travers le tube digestif.
Il faut noter que le suc gastrique est tellement acide qu’il dissout en partie (ou totalement dans le cas de l’insuline par exemple) la plupart des médicaments, avant même qu’ils arrivent dans la circulation sanguine. Le traitement nécessiterait ainsi plusieurs prises, d’être administré par une autre voie, ou d’être doté d’un revêtement protecteur pour aboutir à l’efficacité souhaitée.
Les fragiles molécules d’ARNm sont aussi particulièrement sensibles à cette dégradation. Contourner ce phénomène physiologique ouvre ainsi la voie à de potentiels traitements ou vaccins à administration plus directe, devenant ainsi plus efficaces. « Les acides nucléiques, en particulier l’ARN, peuvent être extrêmement sensibles à la dégradation, en particulier dans le tube digestif. Surmonter ce défi offre de multiples approches thérapeutiques, y compris la vaccination potentielle par voie orale », déclare dans un communiqué Giovanni Traverso, co-auteur principal de l’étude, professeur adjoint de développement de carrière Karl van Tassel en génie mécanique au MIT et gastro-entérologue au Brigham and Women’s Hospital.
Plus avantageux que les injections
La voie orale est souvent la plus appréciée autant par le clinicien que par le patient. Elle est plus utilisée que les injections malgré leur réputation d’être plus efficace que ces dernières. Certains patients, surtout les enfants, acceptent mal les injectables. Ce type d’administration peut entraîner une gêne et une faible adhérence au traitement. De plus, il nécessite l’appel à un professionnel qualifié pour la piqûre.
Pour pallier ce genre de problème, les chercheurs ont testé leur capsule sur des porcs. Ils ont alors constaté qu’elle permettait de faire passer un volume d’insuline dans la circulation sanguine de l’animal équivalent à une injection sous-cutanée standard.
L’exploit est d’autant plus fascinant, car ses concepteurs avaient déjà montré qu’ils pouvaient utiliser la capsule pour délivrer de grosses molécules, comme des anticorps monoclonaux sous forme liquide. Les chercheurs ont alors utilisé la capsule pour délivrer des acides nucléiques, puisque ce sont de grosses molécules. Le résultat est impressionnant : elle a permis de délivrer jusqu’à 150 microgrammes d’ARN au-delà de l’estomac d’un porc. C’est beaucoup plus que la quantité utilisée dans les vaccins à ARNm anti-COVID.
Il est en effet important de noter que, la transfection — le processus qui permet d’introduire des acides nucléiques directement dans les cellules — est difficile à cibler par voie parentérale, la plus utilisée pour les vaccins. Tandis que cette voie orale permet une transfection locale, directement au niveau des cellules de la muqueuse gastro-intestinale.
Livraison d’ARNm
Comme expliqué plus haut, la capsule du MIT est capable de livrer localement une importante quantité d’ARNm. Pour tester cela, le groupe de recherche a conçu un type de nanoparticule unique contenant des acides nucléiques. L’avantage est de pouvoir pénétrer facilement la paroi des cellules cibles pour livrer la charge utile d’ARNm.
Ces nanoparticules ont ensuite été lyophilisées et emballées dans la fameuse capsule. Des expérimentations sur plusieurs modèles animaux ont alors démontré que les cellules ciblées ont bien synthétisé les molécules souhaitées. Les ARNm livrés ont ordonné avec succès aux cellules gastriques des cobayes de coder des protéines rapporteuses inoffensives qui ordonnent à leur tour au tissu de reprendre le « plan de construction ARNm » et fabriquer les molécules souhaitées.
Alex Abramson, co-auteur principal de l’étude, souligne toutefois que des travaux supplémentaires sont nécessaires pour déterminer si les vaccins à ARNm administrés de cette manière peuvent conduire à des réponses immunitaires systémiques. Mais compte tenu du volume important de cellules immunitaires dans la muqueuse gastro-intestinale, la piste est sûrement prometteuse.
De larges perspectives peuvent être envisagées, telles que de nouveaux traitements ciblés pour les maladies gastro-intestinales. « Dans le cas d’une administration systémique par injection intraveineuse ou sous-cutanée, il n’est pas très facile de cibler l’estomac », explique Abramson. « Nous voyons cela comme un moyen potentiel de traiter différentes maladies présentes dans le tractus gastro-intestinal », conclut-il.