En Europe, comme dans la plupart des pays du monde, les femmes vivent entre 3 et 10 ans de plus que les hommes. Mais des chercheurs de l’Université d’Otago, en Nouvelle-Zélande, ont peut-être trouvé la solution pour réduire cette inégalité : une expérience sur des ovins a montré que la castration des mâles retardait le vieillissement de leur ADN.
La durée de vie chez les mammifères (y compris les humains) dépend fortement du sexe d’un individu, les femelles possédant généralement un avantage de longévité. Néanmoins, les mécanismes qui sous-tendent la longévité dépendante du sexe ne sont actuellement pas clairs. Pour mieux comprendre le phénomène, des chercheurs se sont penchés sur le cas des moutons : ils ont notamment établi leur horloge épigénétique, afin de pouvoir mesurer le vieillissement de leur ADN. Leurs résultats viennent d’être publiés dans eLife.
Les scientifiques, tout comme les éleveurs d’ovins, savent depuis longtemps que l’élimination des hormones mâles par castration améliore la longévité des bêtes par rapport à leurs congénères non castrés. Mais « c’est la première fois que quelqu’un examine l’ADN pour voir s’il vieillit également plus lentement », précise Victoria Sugrue, doctorante en anatomie à l’Université d’Otago et co-auteure de l’étude.
La castration féminise des parties de l’épigénome et retarde le vieillissement
Les horloges épigénétiques sont de puissants biomarqueurs biologiques capables d’estimer avec précision l’âge chronologique et d’identifier de nouveaux facteurs influençant le taux de vieillissement, uniquement à partir des données de méthylation de l’ADN — un processus biologique majeur de notre organisme qui concerne de nombreux tissus et types de cellules, mais qui tend à diminuer avec l’âge. L’inventeur de l’horloge épigénétique et co-auteur de cette nouvelle étude, le professeur Steve Horvath, de l’Université de Californie à Los Angeles, explique : « Nous avons mis au point un moyen de mesurer l’âge biologique chez un large éventail de mammifères — nous avons examiné plus de 200 espèces à ce jour et découvert des points communs surprenants dans le vieillissement des animaux ».
Cette étude sur les moutons est toutefois unique, car elle isole spécifiquement les effets des hormones mâles sur le vieillissement. À partir de l’ADN purifié de 432 moutons, l’équipe a développé la première horloge épigénétique pour les moutons domestiques, qui permet de prédire l’âge chronologique avec une erreur absolue médiane de 5,1 mois. En examinant les données, les chercheurs ont découvert que les mâles et les femelles ont des schémas de vieillissement de l’ADN très différents ; en outre, les moutons castrés étaient susceptibles de vivre bien plus longtemps que les mâles non castrés. Ces moutons mâles castrés présentaient d’ailleurs des caractéristiques très féminines sur des sites spécifiques de l’ADN.
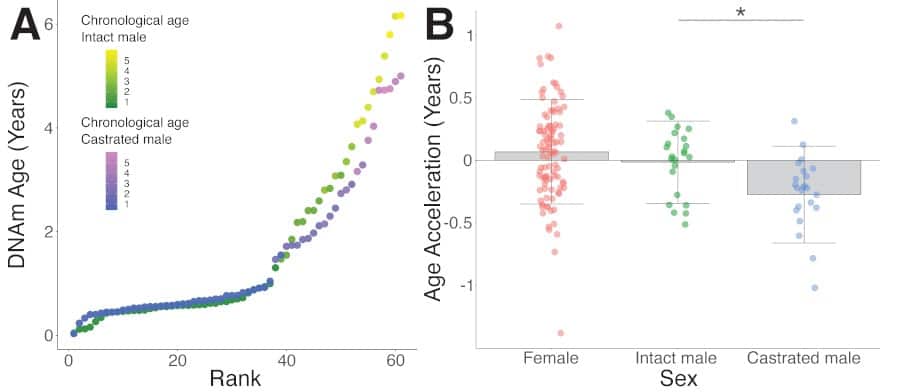
En particulier, l’équipe a identifié plusieurs dinucléotides CpG — des segments d’ADN de deux nucléotides dont la séquence de bases nucléiques est CG — sensibles aux androgènes, qui deviennent progressivement hypométhylés avec l’âge chez les mâles intacts, mais restent stables chez les mâles castrés et les femelles.
Des schémas de méthylation sensibles aux androgènes
Pour déterminer précisément quels tissus sont fortement affectés par les niveaux d’hormones, les chercheurs ont par ailleurs examiné les changements de méthylation dans plusieurs tissus de souris. Dans les tissus où se trouvent les récepteurs hormonaux mâles (par exemple dans la peau, les reins et les muscles), ils ont noté de grandes différences entre les profils d’ADN des mâles et des femelles ; en revanche, les tissus sans expression des récepteurs hormonaux mâles semblaient identiques chez les deux sexes.
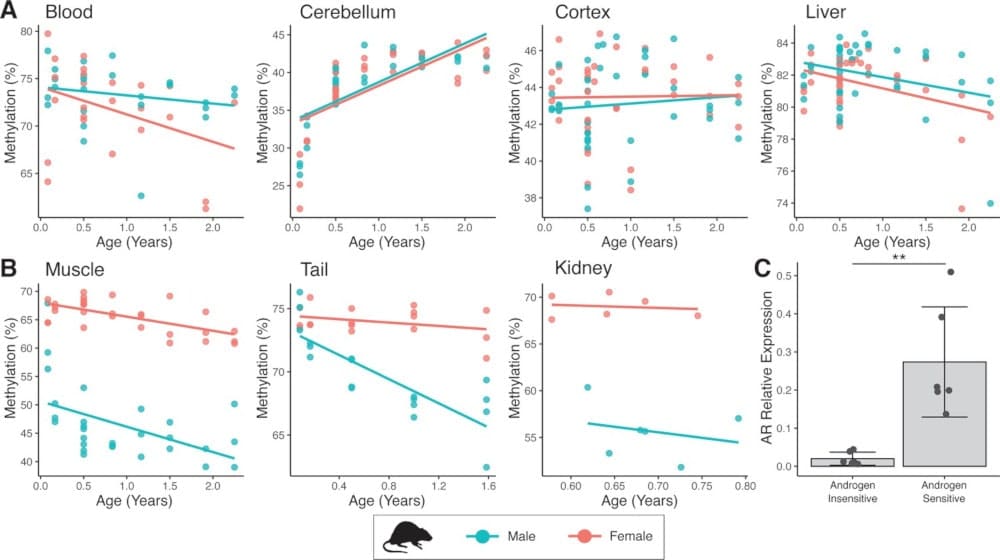
« La plupart des chercheurs utilisent le sang pour mesurer l’âge biologique, et nous l’avons également fait pour les moutons ; cependant, ce n’était pas dans le sang, mais dans la peau que nous avons trouvé des effets de vieillissement spécifiques au sexe dans l’ADN des moutons », explique le Dr Tim Hore, co-responsable de l’équipe de recherche. Cela semblait être également le cas chez les souris.
Selon les scientifiques, les mêmes résultats pourraient être observés chez les humains. « Il est intéressant de noter que les sites les plus affectés par la castration se lient également aux récepteurs des hormones mâles chez les humains à un taux beaucoup plus élevé que ce à quoi nous nous attendrions par hasard », a déclaré le Dr Tim Hore, co-responsable de l’équipe de recherche. Cette étude met donc clairement en évidence le lien entre la castration, les hormones mâles et les différences spécifiques au sexe dans le processus de vieillissement de l’ADN.
Bien entendu, la « méthode » ne peut être envisagée pour prolonger la vie des humains… Mais cette recherche pourrait permettre aux éleveurs d’identifier les moutons qui vivront le plus longtemps (et qui seront donc plus productifs). En Nouvelle-Zélande, un mouton baptisé « Shrek » — célèbre pour sa toison de 27 kg, qu’il a développé en échappant au rassemblement des troupeaux pendant six ans — a vécu jusqu’à l’âge de 16 ans, soit bien plus que l’âge maximal moyen des moutons, estimé à dix ans. Et il s’avère que Shrek était un mâle castré.