Parmi les nombreux symptômes liés à la COVID-19, certains patients font état d’un « brouillard cérébral » persistant. Ces troubles neurologiques, qui associent une fatigue intense et une baisse d’acuité mentale, peuvent durer des semaines, des mois, voire des années. Des chercheurs ont découvert comment le virus du SARS-CoV-2 affecte certaines cellules cérébrales de la substance blanche. Ces effets seraient similaires à ceux observés après une chimiothérapie.
Perte de mémoire, baisse de la concentration, anxiété, troubles de l’humeur et du sommeil, sont tout autant de troubles neurologiques signalés par certaines personnes infectées par le SARS-CoV-2. Et ceux-ci pourraient être plus fréquents que l’on ne croit : selon une étude publiée l’an dernier, les troubles cognitifs persistants affectent environ un ancien malade de la COVID-19 sur quatre. Plus fréquents chez les cas sévères (ayant nécessité une hospitalisation), ils concernent même des individus n’ayant présenté que des symptômes légers.
Une étude plus récente, publiée au mois de mars dans Nature, a fourni quant à elle des preuves d’anomalies structurelles dans le cerveau des personnes infectées. L’impact du virus sur le cerveau est donc aujourd’hui indéniable, mais la façon dont ce « brouillard cérébral » se développe reste peu claire. Les spécialistes ont néanmoins remarqué que les symptômes cognitifs observés n’étaient pas sans rappeler le syndrome de déficience cognitive liée au traitement du cancer. Cette similitude est porteuse d’un nouvel espoir de traitement.
Des taux élevés de cytokines dans le liquide céphalo-rachidien
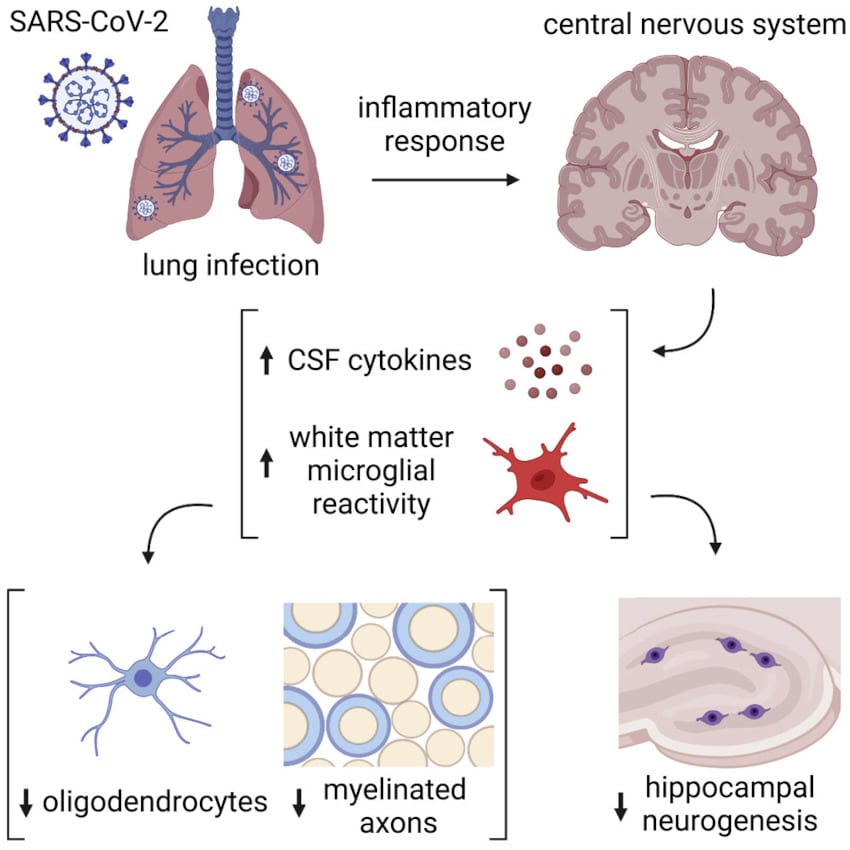
Dans les deux cas, les dommages concernent les mêmes cellules et processus cérébraux. « Nous avons découvert que même une infection légère au SARS-CoV-2 peut provoquer une inflammation importante dans le cerveau, qui dérègle les cellules cérébrales et qui peut contribuer à une déficience cognitive », a déclaré Michelle Monje, professeure de neurologie à l’Université de Stanford, qui a co-dirigé l’étude avec Akiko Iwasaki, professeur d’immunologie à Yale.
Monje étudie les troubles cognitifs post-chimiothérapie depuis plusieurs années. Elle a notamment découvert que le traitement altérait la myéline, qui constitue la gaine protectrice des axones des neurones de la substance blanche. Ces dommages ralentissent la transmission des signaux nerveux. « Lorsque la pandémie a commencé, j’ai commencé à m’inquiéter de voir des conséquences neurologiques similaires de ce virus profondément immunogène », relate-t-elle.
Pour étudier le phénomène de plus près, la spécialiste et ses collègues ont examiné le cerveau de souris légèrement infectées par le SARS-CoV-2 pour évaluer les changements induits par le virus. Les souris présentaient des infections bénignes et ne montraient aucun signe évident de maladie ; les chercheurs n’ont par ailleurs trouvé aucune trace du virus dans leur cerveau.
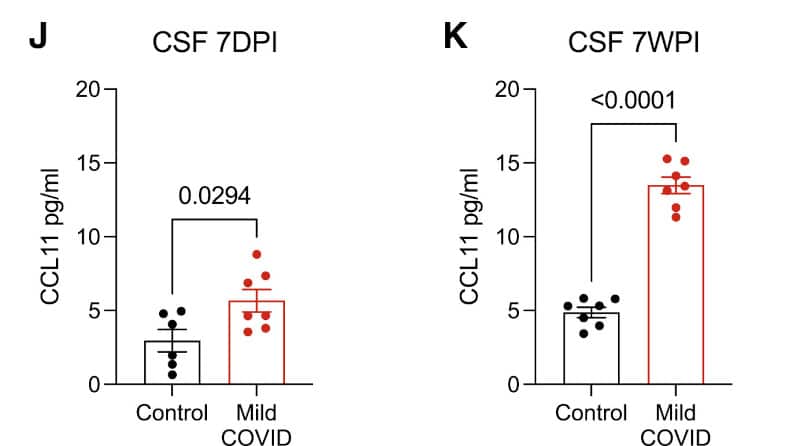
En revanche, les rongeurs affichaient des concentrations plus élevées que la normale de cytokines inflammatoires dans leur sang et leur liquide céphalo-rachidien (LCR), à sept jours, puis à sept semaines après l’infection. Dans le LCR, les niveaux de CCL11 — une chimiokine associée à des troubles cognitifs liés au vieillissement — avaient même bien augmenté en sept semaines. « Ces résultats indiquent qu’une infection respiratoire isolée par le SRAS-CoV-2 peut entraîner des modifications profondes et prolongées des cytokines dans le système nerveux central », notent les chercheurs.
L’équipe a par ailleurs observé que les cellules de la microglie — les macrophages du système nerveux central, chargés d’éliminer les débris cellulaires par phagocytose — étaient beaucoup plus actives que la normale. Là encore, cette suractivité était toujours détectable sept semaines après l’infection. Les chercheurs ont relevé qu’elle était particulièrement soutenue dans l’hippocampe, la région cérébrale impliquée dans l’apprentissage et la mémoire, et qu’elle concernait une sous-population unique de microglie dans la substance blanche appelée « microglie des voies axonales ».
Une suractivité de la microglie qui endommage les cellules cérébrales
Ces cellules microgliales sont particulièrement sensibles aux stimuli inflammatoires. Surstimulées, elles commencent à s’attaquer à des neurones sains ou à d’autres cellules cérébrales, perturbant au passage l’homéostasie du cerveau. Dans l’hippocampe, ce « zèle immunitaire » peut empêcher la création de nouveaux neurones et donc, impacter la mémoire.
En conséquence, l’équipe a observé des changements majeurs au niveau des cellules cérébrales qui synthétisent la myéline, appelées oligodendrocytes. Ces cellules ont été endommagées même en cas de forme légère de COVID-19 : le nombre d’oligodendrocytes matures a diminué de près d’un tiers après l’infection. Les chercheurs ont également constaté une perte de myéline, qui pouvait être détectée dès la première semaine et persistait sept semaines après l’infection.


D’autres infections virales sont connues pour provoquer une inflammation cérébrale. À titre de comparaison, les chercheurs ont donc entrepris d’observer les changements cérébraux chez la souris après une infection au virus H1N1. Au bout d’une semaine, le virus H1N1 a engendré des schémas similaires d’élévation des taux de cytokines dans le système nerveux central, de réactivité microgliale et de perte d’oligodendrocytes dans la matière blanche. En revanche, la réactivité microgliale et la perte d’oligodendrocytes n’étaient pas notables sept semaines après l’infection.
Monje et ses collègues ont ensuite analysé des échantillons de cortex humain et de substance blanche sous-corticale, prélevés sur neuf individus décédés au printemps 2020 (dont quatre présentaient des symptômes de la COVID-19). L’examen pulmonaire de ces cas a révélé des lésions pulmonaires associées à une infection allant de nulle à modérée. Tout comme chez les modèles murins, les tissus humains présentaient une expression accrue du marqueur CD68, traduisant une réactivité microgliale accrue dans la substance blanche sous-corticale.
Enfin, l’équipe s’est livrée à une ultime comparaison des niveaux sanguins de la cytokine CCL11 chez des personnes souffrant de COVID long : ils ont constaté que 48 d’entre elles présentaient des symptômes cognitifs et des niveaux de CCL11 élevés par rapport à 15 autres personnes ne présentant pas de symptômes cognitifs — confirmant l’implication de cette cytokine dans le brouillard cérébral.
Alors que Monje et ses collègues développent des traitements pour limiter les symptômes liés à la chimiothérapie, ils prévoient de les appliquer sur des modèles murins de COVID-19 pour tester leur efficacité. Mais la spécialiste reste prudente : « S’il existe de nombreuses similitudes avec les troubles cognitifs après un cancer, il y a probablement aussi des différences ».