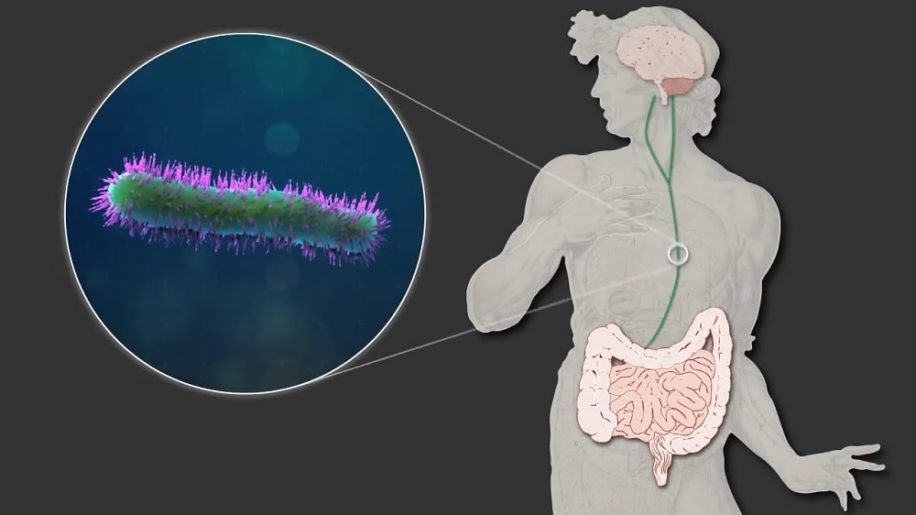
Au cours des dernières années, plusieurs études ont amené les scientifiques à considérer l’intestin comme un « second cerveau ». Plus encore, des observations détaillées ont mis en évidence des voies de signalisation directes établies entre l’intestin et notre cerveau, contribuant à de nombreux mécanismes physiologiques. Et récemment, cette relation particulière a de nouveau été confirmée. En effet, une équipe de biologistes a montré que le microbiote intestinal régulait une population de cellules cérébrales auparavant non identifiées permettant de lutter contre l’inflammation du cerveau et du système nerveux central.
Les astrocytes sont le type de cellules le plus abondant dans le système nerveux central (SNC), mais ils restent mal caractérisés. Les chercheurs ont longtemps supposé que la fonction principale des astrocytes est de fournir des nutriments et un soutien aux cellules nerveuses du cerveau. Au fil des ans, cependant, de plus en plus de preuves ont montré que les astrocytes peuvent également promouvoir activement la neurodégénérescence, l’inflammation et les maladies neurologiques.
Une équipe dirigée par des chercheurs du Brigham and Women’s Hospital a montré qu’une sous-population spécifique d’astrocytes peut faire le contraire, en remplissant plutôt une fonction protectrice anti-inflammatoire cérébrale basée sur des signaux régulés par les bactéries qui résident dans l’intestin. Les résultats sur cette nouvelle voie anti-inflammatoire ont été publiés dans la revue Nature.
« C’est le premier cas dans lequel nous montrons qu’au moins un sous-ensemble de ces cellules (astrocytes) peut empêcher l’inflammation. La raison pour laquelle nous n’avons pas vu cela auparavant était parce que nous étudiions ces cellules comme si elles étaient uniformes, homogènes. Mais maintenant, nous avons la résolution suffisante pour voir les différences entre ces cellules », explique Francisco Quintana, du Centre Ann Romney pour les maladies neurologiques.
Microbiote intestinal : il pilote l’activité anti-inflammatoire des astrocytes
Les chercheurs ont utilisé des outils perfectionnés d’analyse des gènes et des protéines pour identifier le nouveau sous-ensemble d’astrocytes. La population d’astrocytes réside à proximité des méninges (la membrane entourant le cerveau) et exprime une protéine appelée LAMP1, ainsi qu’une protéine appelée TRAIL, qui peut induire la mort d’autres cellules. Ces caractéristiques aident les astrocytes LAMP1 + TRAIL à limiter l’inflammation du SNC en induisant la mort des cellules T qui favorisent l’inflammation.
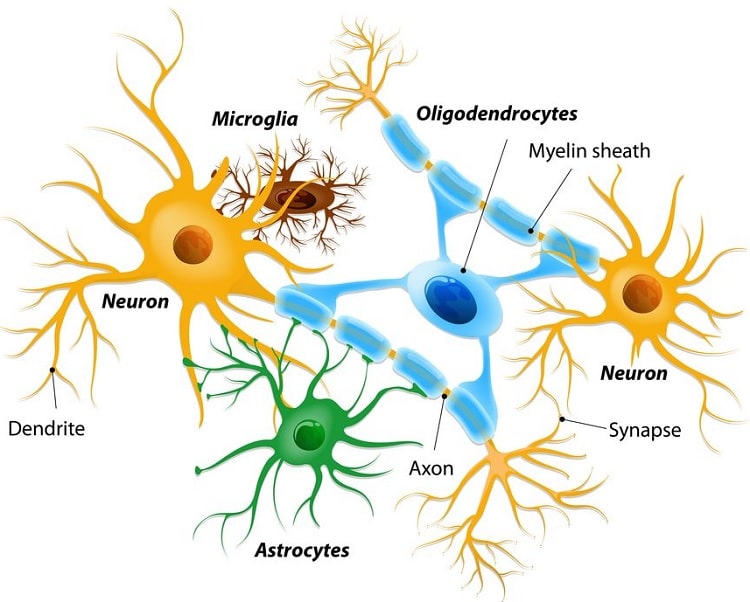
Pour déterminer quel mécanisme contrôle les astrocytes LAMP1 + TRAIL + dans le cerveau, les chercheurs ont réalisé une série de tests à l’aide de l’outil d’édition de gènes CRISPR-Cas9. Ils ont découvert qu’une molécule de signalisation particulière, appelée interféron-gamma, régule l’expression de TRAIL. De plus, ils ont constaté que le microbiote intestinal induit l’expression de l’interféron-gamma dans les cellules qui circulent à travers le corps et atteignent finalement les méninges, où ils peuvent favoriser les activités anti-inflammatoires des astrocytes.
De futures thérapies contre les maladies neurologiques et tumeurs cérébrales
Comprendre les mécanismes pilotant les fonctions anti-inflammatoires des astrocytes LAMP1 + TRAIL pourrait permettre aux chercheurs de développer des approches thérapeutiques pour lutter contre les maladies neurologiques, comme la sclérose en plaques. Par exemple, ils explorent des candidats probiotiques qui peuvent être utilisés pour réguler l’activité anti-inflammatoire des astrocytes. De plus, les données les plus récentes de l’équipe de recherche indiquent que certaines tumeurs cérébrales exploitent cette voie pour échapper à la réponse immunitaire du corps.
Les chercheurs développent donc des immunothérapies anticancéreuses pour riposter contre les attaques des tumeurs. « La découverte de sous-ensembles anti-inflammatoires d’astrocytes contrôlés par le microbiote est une avancée importante dans notre compréhension de l’inflammation du SNC et de sa régulation. C’est un mécanisme très nouveau par lequel l’intestin contrôle l’inflammation dans le cerveau. Il guide de nouvelles thérapies pour les maladies neurologiques, et nous pensons que ce mécanisme pourrait contribuer à la pathogenèse des tumeurs cérébrales », déclare Quitana.