Les troubles du spectre de l’autisme (TSA), qui se manifestent le plus souvent dès la petite enfance, résultent d’anomalies du neurodéveloppement. Il en existe une grande diversité, chaque trouble impactant plus ou moins le comportement, les réactions sensorielles, et les capacités d’insertion sociale et cognitives de la personne qui en souffre. Plusieurs facteurs sont à l’origine des TSA, parmi lesquels les mutations génétiques qui s’opèrent dans les cellules cérébrales. Une nouvelle étude précise aujourd’hui comment ces mutations entraînent un comportement autiste chez les individus de sexe masculin.
Les TSA sont liés à des anomalies très précoces (anténatales) du système nerveux, des défauts de connexions dans les régions cérébrales dédiées à la communication, à la modulation du comportement selon l’environnement, à la capacité d’adaptation. Leur origine est multifactorielle (facteurs environnementaux, prise de certains médicaments pendant la grossesse, naissance prématurée), mais le facteur génétique est prépondérant ; la recherche médicale a déjà identifié plus d’une centaine de mutations génétiques impliquées dans le développement de ces troubles. Être du sexe masculin, notamment, est l’un des facteurs de risque reconnus.
Un processus d’élagage défaillant
Les difficultés d’insertion sociale, les comportements répétitifs, l’hypersensibilité aux sons et à la lumière, la réticence au changement, sont tout autant d’expressions d’un TSA. De nombreux cas résultent de défaillances au niveau des cellules nerveuses. Une équipe de l’Institut de recherche Scripps, en Floride, a donc étudié les mutations génétiques qui sont à l’origine de ces dysfonctionnements. Il s’avère qu’elles provoquent une surproduction de plusieurs protéines dans les cellules cérébrales. Reste à comprendre comment ce surplus de protéines conduit à un TSA.
L’effet le plus notable de cette surproduction se produit dans les cellules immunitaires spécifiques du système nerveux central, les cellules microgliales ; elles ont une fonction d’épuration et d’élimination des déchets au niveau des substances blanche et grise. En temps normal, ces cellules, qui constituent la « microglie », sont donc chargées d’éliminer les connexions cérébrales (synapses) inutiles ou non souhaitées, qui se forment au tout début de la vie et à mesure que le cerveau se développe.
Or, à partir de tests effectués sur la souris, les neuroscientifiques ont découvert que la surproduction de protéines altère le fonctionnement des cellules microgliales, qui ne peuvent plus assurer leur « élagage » correctement. Un phénomène qui ne s’observe que chez les sujets mâles et qui conduit à des troubles du comportement semblables à l’autisme. Ce résultat vient corroborer l’hypothèse selon laquelle les TSA sont cinq fois plus répandus chez les hommes que chez les femmes. Il confirme également que le cerveau des personnes atteintes d’un TSA comporte un nombre de synapses bien plus élevé que la normale.
Les chercheurs à l’origine de cette nouvelle étude ont donc mis en évidence que les déficiences de la microglie jouent un rôle clé dans l’apparition des TSA, notamment chez l’homme. Ce qui ouvre potentiellement la voie à la mise en œuvre d’un traitement : « La microglie pourrait être une bonne cible pour les futurs médicaments qui préviennent ou traitent les troubles du spectre autistique », confirme Baoji Xu, auteur principal de l’étude et professeur au département de neuroscience à Scripps Research.
Un phénomène propre au cerveau masculin
Les anomalies génétiques liées à l’autisme sont pour la plupart clairement identifiées. Ainsi, les mutations au niveau des gènes PTEN, TSC1, TSC2 et FMR1, sont à l’origine d’environ 3 % des cas de TSA. Dans le cadre de leur étude, Xu et ses collègues ont cherché à déterminer si un type de cellule cérébrale en particulier pouvait expliquer le lien entre la surproduction de protéines et les comportements de type autisme. Pour ce faire, ils ont utilisé des souris pour produire – dans un seul type de cellule à la fois – des niveaux anormalement élevés d’une protéine appelée eIF4E. Un taux élevé d’eIF4E serait en effet l’un des paramètres communs aux mutations génétiques énoncées plus haut.
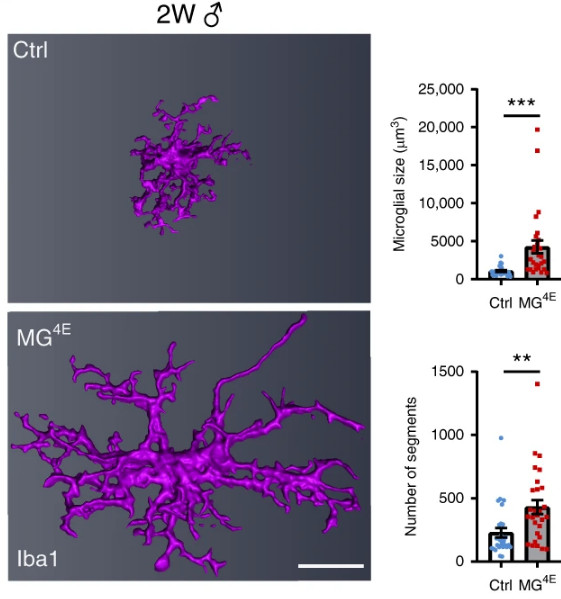
Résultat : l’équipe a découvert que lorsque la production d’eIF4E est élevée dans les cellules microgliales, les souris développent des anomalies de type TSA (déficits cognitifs et troubles du comportement). Par ailleurs, bien que la production de protéines ait augmenté dans les cellules microgliales des deux sexes, les anomalies de type TSA ne se sont produites que chez les souris mâles. Parallèlement, aucune anomalie du même type n’a été observée avec un niveau tout aussi élevé d’eIF4E dans les autres cellules cérébrales (neurones ou astrocytes). Les cellules microgliales sont donc bien le cœur du problème.
Sur le même sujet : 12 enfants autistes conçus à partir du même donneur de sperme : existerait-il un « gène de l’autisme » unique ?
En examinant de plus près les cellules microgliales affectées, les chercheurs ont constaté que chez les jeunes souris mâles, ces cellules étaient significativement plus grandes et également plus nombreuses dans d’importantes régions du cerveau (cortex préfrontal médian, hippocampe et striatum). Chez les femelles en revanche, ces changements étaient beaucoup plus subtils et transitoires. L’expérience a en outre révélé que les cellules microgliales n’avaient pas la capacité de mouvement habituelle qui leur permettrait de remplir leurs fonctions d’élagage des synapses.
Xu et ses collègues soupçonnent que cette réduction de la motilité microgliale soit le facteur le plus important dans le développement des TSA : l’inhibition de leurs capacités d’élagage entraîne des changements cérébraux conduisant aux anomalies de type TSA. À présent, l’équipe poursuit son étude pour découvrir précisément pourquoi la surproduction de protéines affecte beaucoup plus la microglie chez les hommes que chez les femmes. Une information supplémentaire, qui permettrait de lever le voile sur les différences sexuelles observées dans l’autisme et qui pourrait mener à une nouvelle piste de traitement.