Face à l’importance et l’utilisation croissantes des cellules souches dans les traitements médicaux, la capacité de les produire efficacement et en toute sécurité est cruciale. Des scientifiques ont mis au point une technique innovante pour transformer des cellules spécialisées en cellules souches en effaçant leur mémoire cellulaire. Cette approche pourrait améliorer la qualité des cellules souches utilisées en médecine régénérative, rendant les thérapies plus sûres et plus efficaces.
La médecine régénérative, axée sur la capacité du corps à se réparer lui-même, repose largement sur l’utilisation de cellules souches. Ces unités cellulaires, dotées d’une capacité unique à se transformer en n’importe quel type de cellule du corps, sont au cœur de nombreuses recherches visant à traiter des maladies autrefois considérées comme incurables.
Récemment, des chercheurs ont mis en lumière une méthode permettant de reprogrammer des cellules somatiques en cellules souches pluripotentes induites, en effaçant au préalable leur mémoire cellulaire. Cette avancée, résultant d’une étude dirigée par le professeur Ryan Lister de l’Institut de recherche médicale Harry Perkins et de l’Université d’Australie occidentale et le professeur Jose M Polo de l’Université Monash et de l’Université d’Adélaïde, pourrait redéfinir notre approche des thérapies basées sur les cellules souches et leurs applications potentielles. L’étude est disponible dans la revue Nature.
Le défi de la mémoire cellulaire
La reprogrammation de cellules somatiques — qui sont des cellules spécialisées présentes dans notre corps — en cellules souches pluripotentes induites (iPS) est une procédure complexe. Elle repose sur l’introduction de facteurs de transcription spécifiques, notamment OCT4, KLF4, SOX2 et MYC. Ces facteurs jouent un rôle clé dans la conversion des cellules somatiques en iPS, leur permettant d’acquérir des propriétés similaires à celles des cellules souches embryonnaires (ES).
Toutefois, bien que les iPS et les ES partagent de nombreuses caractéristiques, elles ne sont pas identiques. Les iPS, malgré leur capacité à se différencier en divers types de cellules, montrent des variations épigénétiques et fonctionnelles par rapport aux ES. L’épigénétique concerne les modifications chimiques de l’ADN et des protéines associées qui peuvent influencer l’expression des gènes sans changer la séquence d’ADN elle-même.
Ces variations entre iPS et ES sont souvent liées à ce que l’on appelle la « mémoire épigénétique » des cellules somatiques. Même après la reprogrammation, les iPS peuvent conserver certaines marques épigénétiques de leur état antérieur de cellule somatique. Cette mémoire résiduelle peut influencer le comportement et les caractéristiques des iPS, les rendant légèrement différentes des cellules souches embryonnaires.
Une nouvelle stratégie de reprogrammation
Pour pallier ce problème, les chercheurs ont développé une nouvelle méthode appelée « reprogrammation transitoire naïve ». Cette stratégie s’inspire du processus naturel de réinitialisation épigénétique qui se produit dans les embryons avant leur implantation dans l’utérus. En imitant ce processus, les scientifiques espèrent obtenir des cellules reprogrammées qui sont non seulement similaires aux cellules souches embryonnaires en matière de fonctions, mais qui sont également dépourvues des marques épigénétiques indésirables associées à leur état antérieur.
Le Dr Sam Buckberry, informaticien à l’Institut Harry Perkins, l’UWA et le Telethon Kids Institute et co-auteur principal de l’étude, a déclaré qu’en étudiant comment l’épigénome des cellules somatiques a changé tout au long du processus de reprogrammation, ils ont identifié le moment où des aberrations épigénétiques sont apparues. Ils ont ainsi pu introduire une nouvelle étape de réinitialisation de l’épigénome pour les éviter et effacer la mémoire. Pour cela, ils utilisent notamment des facteurs de transcription viraux Sendai OKSM.
Le professeur Jose Polo, du Monash Biomedicine Discovery Institute et co-auteur, explique dans un communiqué : « Cela réduit considérablement les différences entre les cellules iPS et les cellules ES et maximise l’efficacité de l’application des cellules iPS humaines ». Leur méthode suggère que la mémoire épigénétique résiduelle n’est pas une conséquence inévitable du processus de reprogrammation. Au contraire, il pourrait être possible de minimiser, voire d’éliminer, ces marques épigénétiques résiduelles.
Des résultats prometteurs
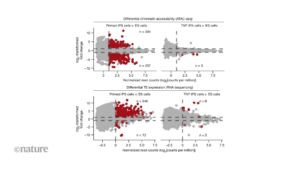
La nouvelle méthode de reprogrammation a montré des résultats impressionnants. Les cellules iPS produites par cette technique étaient morphologiquement et moléculairement similaires aux cellules ES. Cela signifie que, sur le plan biochimique et génétique, ces cellules iPS nouvellement reprogrammées sont presque indiscernables des cellules ES.
L’un des aspects les plus remarquables de cette nouvelle méthode est sa capacité à corriger les anomalies épigénétiques. Comme mentionné précédemment, l’une des principales préoccupations concernant les cellules iPS reprogrammées par des méthodes traditionnelles est la persistance de marques épigénétiques résiduelles, témoins de leur état antérieur de cellule somatique. Cependant, avec cette nouvelle approche, les cellules iPS montrent une réduction significative de ces marques résiduelles. En d’autres termes, elles subissent une « correction épigénétique » qui les rapproche encore plus de l’état naturel des cellules ES.


Cette avancée en matière de reprogrammation cellulaire ouvre de nouvelles perspectives pour la médecine régénérative. Les cellules iPS jouent déjà un rôle central dans divers domaines médicaux. Elles permettent, par exemple, de reproduire des maladies spécifiques en laboratoire pour mieux les comprendre, d’effectuer des tests préliminaires sur de nouveaux médicaments ou encore de développer des traitements basés sur la transplantation de cellules. Si ces iPS peuvent être produites de manière à être quasiment identiques aux cellules ES, leur utilisation deviendrait potentiellement plus fiable et plus sûre, optimisant ainsi les résultats des thérapies et des recherches basées sur ces cellules.