Des chercheurs ont mis au point un implant capable de traiter le diabète de type 1 sans recourir à l’immunosuppression, grâce à un apport supplémentaire d’oxygène aux cellules productrices d’insuline qu’il transporte. Contrairement aux dispositifs antérieurs, ce nouvel implant alimente une densité suffisante de cellules pancréatiques grâce à un mini-générateur électrochimique d’oxygène amovible. Cette approche innovante pourrait, à terme, être adaptée au traitement d’autres maladies chroniques.
Le diabète de type 1 est une maladie chronique auto-immune dans laquelle les cellules immunitaires s’attaquent aux cellules bêta du pancréas, responsables de la production d’insuline. Ce déficit entraîne une perte de contrôle de la glycémie, contraignant les patients à une insulinothérapie exogène à vie. Cela exige un effort constant et rigoureux, tout en obligeant les patients à surveiller méticuleusement leur alimentation, leur sommeil, leur niveau de stress, etc.
Malgré les progrès de l’insulinothérapie, les solutions actuelles exposent à des complications potentiellement graves : épisodes sévères d’hypoglycémie ou lésions organiques irréversibles liées à l’hyperglycémie chronique. La thérapie cellulaire est explorée depuis plusieurs décennies pour y remédier. Des essais cliniques de transplantation d’îlots pancréatiques ont ainsi montré qu’il était possible de contrôler la glycémie sans apport exogène d’insuline.
Cette approche reste toutefois limitée : elle impose encore une immunosuppression à vie, avec son cortège d’effets indésirables — infections opportunistes et la néphrotoxicité (une toxicité affectant les reins). L’encapsulation cellulaire, proposée pour s’en affranchir, consiste à insérer les cellules implantées dans une enveloppe semi-perméable qui empêche tout contact direct avec le système immunitaire tout en laissant passer les molécules nécessaires au métabolisme.
Mais un obstacle demeure : la durée de vie de l’implant après transplantation. « L’un des principaux défis réside dans la mort fréquente de l’implant lui-même, faute d’oxygène après son implantation », explique Lora Phuong Tran, doctorante au Département de génie biologique et environnemental de l’Université Cornell (États-Unis), citée par le Cornell Chronicle.
Pour surmonter cette limite, Tran et ses collègues ont conçu un système d’implant doté d’un oxygénateur intégré. « Nous devons répondre à deux exigences : la protection immunitaire et le maintien du transfert de masse, c’est-à-dire le passage du glucose et des autres nutriments ou molécules entrant et sortant », précise-t-elle.
Un mini-générateur d’oxygène intégré
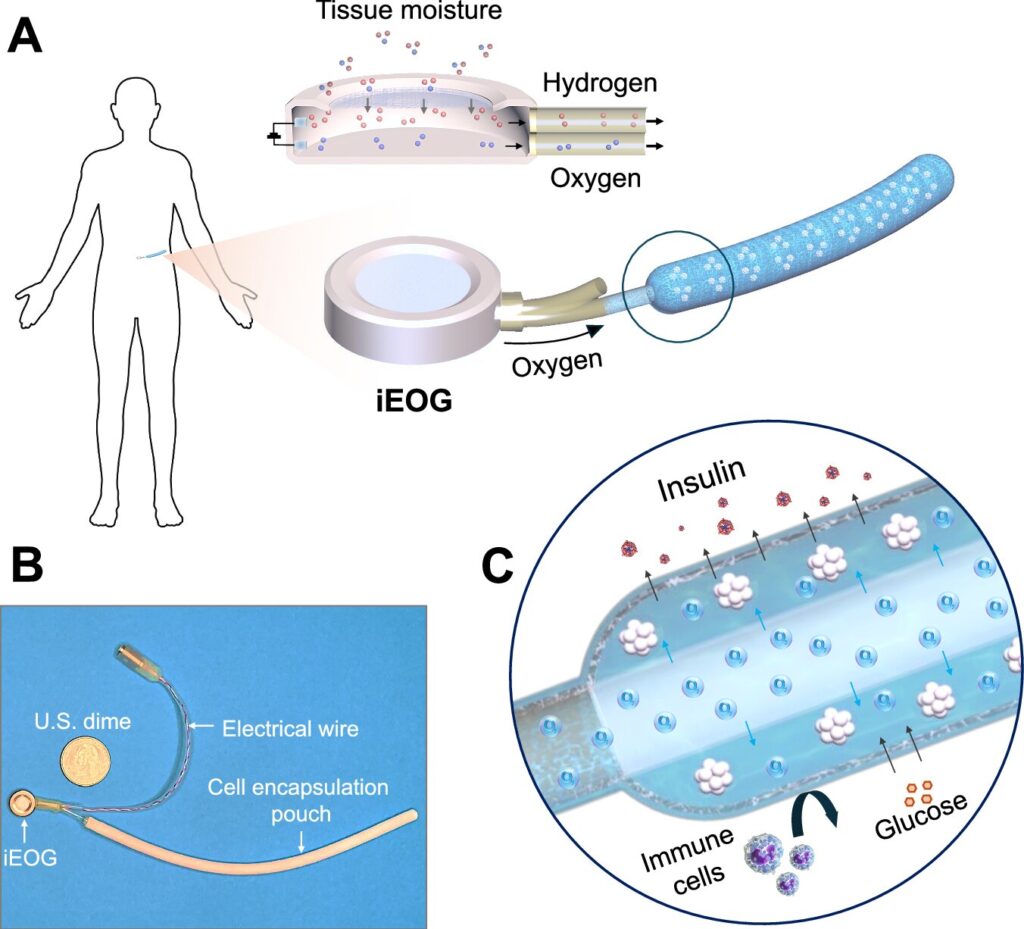
Présenté dans la revue Nature Communications, le dispositif se compose d’une capsule cylindrique à section annulaire renfermant les îlots pancréatiques. Il intègre un générateur électrochimique d’oxygène amovible, de la taille d’une petite pièce de monnaie. Une membrane nanofibreuse entoure la capsule, bloquant l’accès aux cellules immunitaires tout en restant perméable aux molécules comme le glucose.
Une membrane centrale, également perméable, diffuse l’oxygène jusqu’aux amas cellulaires. « Ce système permet un apport continu d’oxygène par électrolyse de l’humidité tissulaire, favorisant une encapsulation cellulaire à haute densité (60 000 IEQ/mL) », écrivent les auteurs.
La technologie prolonge les recherches menées dans le laboratoire de Minglin Ma, professeur d’ingénierie biologique et environnementale au College of Agriculture and Life Sciences (CALS) et auteur principal de l’étude. Testées sur des souris, les précédentes capsules avaient permis un contrôle efficace de la glycémie, mais leur durée de vie restait limitée faute d’oxygénation.
« Dans notre laboratoire, elles ont donné de bons résultats chez des souris ayant vécu plus d’un an, avec un contrôle très efficace du diabète, malgré l’absence de production d’oxygène. Mais à grande échelle, il faut plus de cellules, et donc une densité accrue. Sans oxygénation, les cellules meurent souvent en deux semaines », observe Tran.
Le nouvel implant a été testé avec succès sur des rats. Après implantation sous-cutanée, la capsule a empêché toute infiltration des cellules immunitaires et la membrane est restée fonctionnelle pendant plusieurs mois sans s’encrasser. Le système a inversé le diabète jusqu’à trois mois sans immunosuppression, tandis que les animaux témoins sont restés en hyperglycémie.
Pour les chercheurs, ces résultats confirment que l’implant assure un contrôle glycémique plus précis et pourrait, à terme, améliorer le confort de vie des patients, en leur permettant de s’alimenter et de pratiquer des activités de manière comparable aux personnes non atteintes.
Une possibilité d’application à d’autres maladies chroniques
La prochaine étape de la recherche consistera à tester le dispositif sur des modèles animaux plus grands, comme le porc, ainsi que sur des cellules souches humaines. L’équipe envisage aussi son utilisation à long terme dans le traitement d’autres pathologies chroniques.
« Nous imaginons une époque où des implants contenant des cellules allogéniques issues de lignées de cellules souches humaines pourraient être utilisés sur le long terme pour remplacer des fonctions manquantes de l’organisme », avance Linda Tempelman, coauteure de l’étude.
La capsule pourrait ainsi servir à délivrer des endorphines pour la gestion de la douleur, des enzymes pour les thérapies de substitution enzymatique, ou encore des molécules anti-inflammatoires in situ chez les patients souffrant de maladies auto-immunes marquées par une inflammation incontrôlable.