Des chercheurs ont réalisé une avancée spectaculaire dans le domaine du génie génétique en concevant un organisme synthétique unicellulaire qui croît et se divise comme une cellule naturelle. Ainsi, il imite les aspects du cycle de division cellulaire (la mitose), qui sous-tend et permet une vie cellulaire saine, un processus fondamental dans le monde vivant !
Cette réalisation, donnant lieu à une forme de vie similaire à une bactérie, porte le nom de JCVI-syn3A. C’est le résultat de décennies de séquençage et d’analyse génomique, après avoir exploré les rôles que jouent les gènes individuels dans les organismes cellulaires (les êtres vivants, par extension). Les résultats ont été publiés dans la revue Cell.
« Notre objectif est de connaître la fonction de chaque gène afin de pouvoir développer un modèle complet du fonctionnement d’une cellule », explique le biophysicien James Pelletier du MIT et du National Institute of Standards and Technology (NIST).
L’origine de ces travaux remonte aux années 1990, mais les avancées les plus récentes ont eu lieu au cours de ce siècle. En 2003, des chercheurs ont réussi à synthétiser un petit virus qui infecte les bactéries. Cela a conduit à une nouvelle percée en 2010, lorsque des scientifiques du J. Craig Venter Institute (JCVI), dans le Maryland, ont conçu la première cellule bactérienne synthétique, appelée JCVI-syn1.0 : le premier organisme sur Terre doté d’un génome entièrement synthétique, conçu en retirant l’ADN naturel de la bactérie Mycoplasma mycoides.
Plusieurs années plus tard, l’équipe a franchi une nouvelle étape en créant en laboratoire une espèce de bactérie dont le code génétique est plus petit que celui que l’on trouve dans la nature. Cet organisme, appelé JCVI-syn3.0, ne possédait que 473 gènes au total, soit moins que tout organisme vivant autonome connu dans le monde naturel.
Mais si la boîte à outils génétique miniaturisée de JCVI-syn3.0 lui a permis de se perpétuer par la division cellulaire, il l’a fait d’une manière inhabituelle, en produisant une « variation morphologique frappante » dans les nouvelles cellules qu’il a créées, qui ont émergé dans une variété de formes et de tailles différentes.
Une prouesse rendue possible par l’ajout de 19 gènes
Aujourd’hui, les membres de la même équipe de recherche ont trouvé un moyen d’empêcher ces étranges morphologies de se produire, grâce à une nouvelle variante modifiée de JCVI-syn3.0 connue sous le nom de JCVI-syn3A. Grâce à l’ajout de 19 gènes qui n’étaient pas présents dans JCVI-syn3.0, la nouvelle variante JCVI-syn3A est capable de subir une division cellulaire d’apparence plus normale et plus cohérente, avec beaucoup moins de variations morphologiques que JCVI-syn3.0.
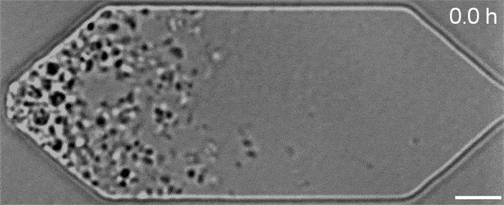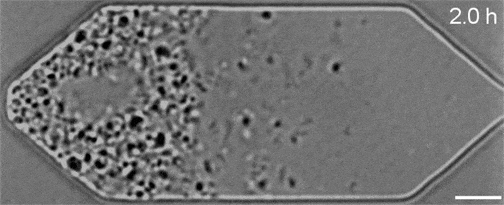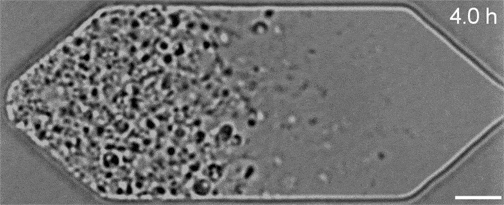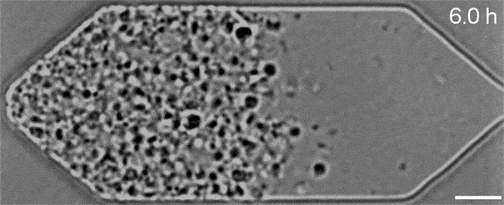
Malgré les nombreuses années de travail qui ont permis d’obtenir ce résultat, ces gènes restent très mystérieux. Par exemple, alors que JCVI-syn3A comporte 19 nouveaux gènes supplémentaires, seuls 7 de ces derniers sont censés jouer un rôle dans le déroulement plus régulier de ses processus de division cellulaire. Et sur ces sept, seuls deux gènes (appelés ftsZ et sepF) ont vu leurs fonctions identifiées…
On ignore encore comment les cinq autres contribuent nécessairement à la cohérence morphologique de JCVI-syn3A, mais une chose est sûre : ce minuscule génome représente désormais la nouvelle norme d’expérimentation, qui pourrait aider les chercheurs à caractériser l’action de ces gènes au sein des organismes. Les séquences vidéo obtenues dans le cadre de l’étude ont permis à l’équipe d’observer comment leurs manipulations génétiques affectaient la croissance et la division des cellules. Si l’élimination d’un gène perturbait le processus normal, ils le remettaient en place et en essayaient un autre.
« JCVI-syn3A offre donc un modèle minimal convaincant pour la physiologie bactérienne et une plateforme pour l’ingénierie biologique au sens large », expliquent les chercheurs dans leur article. « Nous voulons comprendre les règles de conception fondamentales de la vie. Si cette cellule peut nous aider à découvrir et à comprendre ces règles, alors nous sommes prêts pour la course », ajoute Elizabeth Strychalski, chef du groupe d’ingénierie cellulaire du NIST.