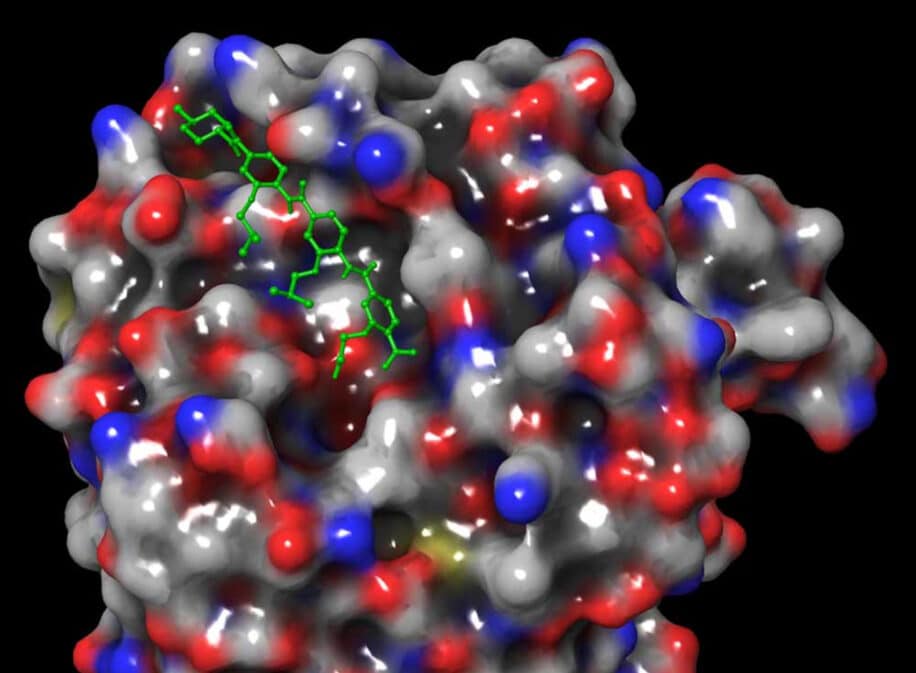
Le cancer du sein triple négatif est particulièrement difficile à traiter. En effet, ses cellules cancéreuses ne sont pas dotées des marqueurs habituellement ciblés par les traitements traditionnels. Des chercheurs ont synthétisé une nouvelle molécule, baptisée ERX-41, capable de se lier à une protéine du réticulum endoplasmique, de manière à induire la mort des cellules cancéreuses du sein. Cette approche constitue un nouvel espoir de traitement des patients atteints de tumeurs solides multiples.
Les cellules du cancer du sein triple négatif (CSTN) ne possèdent pas de récepteurs d’œstrogènes (RE-) ni de progestérone (RP-), ni même de récepteurs de la protéine régulant la multiplication cellulaire (HER2-) — d’où l’expression « triple négatif ». Ils représentent environ 15% des nouveaux diagnostics de cancer du sein. La chimiothérapie reste la principale option de traitement pour les patientes, car l’absence de ces marqueurs empêche l’usage de thérapies ciblées, plus efficaces.
Le CSTN touche des femmes jeunes, de moins de 40 ans. C’est le sous-type de cancer du sein le plus meurtrier et il affiche un taux de rechute important. Il est donc urgent de développer de nouvelles thérapies plus ciblées. L’objectif est de trouver un élément qui caractérise les cellules cancéreuses, mais qui n’est pas observé dans les cellules saines. Le fait que le CSTN présente une grande hétérogénéité moléculaire complique malheureusement les choses. Une équipe de l’Université du Texas à Dallas a néanmoins trouvé le moyen d’exploiter une faille de ces cellules cancéreuses.
Une croissance tumorale significativement réduite
Le Dr Jung-Mo Ahn, professeur associé de chimie et de biochimie à l’UT Dallas, travaille depuis plus d’une décennie sur la conception de petites molécules capables de perturber les interactions protéine-protéine critiques pour améliorer le traitement des cancers. Son équipe et lui ont d’ailleurs déjà développé deux oligobenzamides (D2 et ERX-11) qui se lient respectivement au récepteur des androgènes et au récepteur des œstrogènes ; tous deux sont des composés candidats thérapeutiques potentiels pour le cancer de la prostate (D2) et le cancer du sein résistant au traitement (ERX-11).
Alors qu’ils cherchaient à optimiser ces agents thérapeutiques, ils ont obtenu par hasard une autre molécule (ERX-41), dotée d’une activité robuste contre plusieurs sous-types moléculaires de CSTN. Cette molécule a tout d’abord été testée sur des cellules isolées : « dans 21 lignées cellulaires, représentant tous les sous-types moléculaires de CSTN, ERX-41 a montré une puissante activité antiproliférative », écrivent les chercheurs. La molécule n’a par ailleurs eu aucun effet significatif contre les cellules épithéliales mammaires humaines normales.
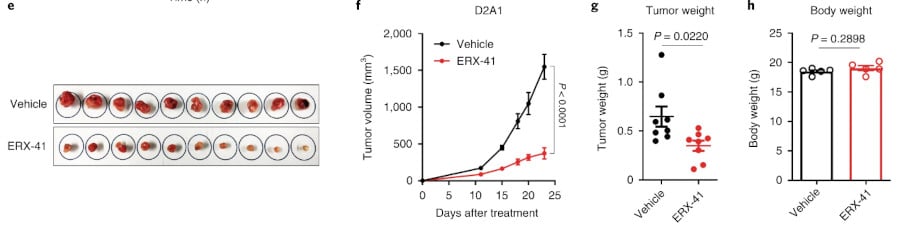
« Les études d’imagerie sur cellules vivantes ont indiqué que ERX-41 induisait de manière significative (>90 %) la mort des cellules CSTN dans les 30 heures de traitement », précise l’équipe. Le composé a également été testé sur des tissus cancéreux humains et sur des modèles murins de cancers humains : il a réduit significativement la croissance tumorale et les souris n’ont montré aucun signe de toxicité (le poids corporel restait inchangé, de même que l’histologie des principaux organes). « Le composé ERX-41 n’a pas tué les cellules saines, mais il a anéanti les cellules tumorales, qu’elles aient ou non des récepteurs aux œstrogènes », a déclaré Ahn dans un communiqué.
Une mort cellulaire due à trop de stress
Au vu des résultats, les chercheurs ont pensé que cette molécule ciblait nécessairement autre chose que les récepteurs d’œstrogènes — qui n’étaient de toute évidence pas le facteur discriminant observé lors des expériences. En examinant de plus près la molécule ERX-41, Ahn et ses collaborateurs ont finalement découvert qu’elle se liait à une protéine cellulaire appelée lipase acide lysosomale A (LIPA). La LIPA se trouve dans un organite cellulaire appelé réticulum endoplasmique — le système de transport des cellules chargé, entre autres, du repliement des protéines.
Pour qu’une cellule tumorale se développe rapidement, elle doit produire beaucoup de protéines, ce qui crée un stress au niveau du réticulum endoplasmique, explique Ahn. Par conséquent, les cellules cancéreuses produisent bien plus de LIPA que les cellules saines. En se liant à LIPA, ERX-41 bloque le traitement des protéines dans le réticulum endoplasmique, ce qui entraîne un stress. « Un stress persistant et sévère du réticulum endoplasmique tue les cellules cancéreuses en induisant leur autophagie, leur apoptose, leur nécroptose ou leur mort cellulaire immunogène », expliquent les chercheurs.
En quelque sorte, ERX-41 aggrave le stress induit de base par le CSTN lui-même, ce qui explique pourquoi il n’a aucun effet sur les cellules saines. « Le cancer du sein triple négatif est particulièrement insidieux : il touche les femmes à un âge plus précoce, il est agressif et résiste aux traitements. Je suis vraiment heureux que nous ayons découvert quelque chose qui a le potentiel de faire une différence significative pour ces patientes », a déclaré Ahn. Des essais cliniques d’ERX-41 devraient être entamés dès le premier trimestre 2023.
Cette molécule a montré de bons résultats dans le cas du CSTN, mais pourrait être utilisée pour traiter d’autres cancers particulièrement difficiles à soigner. Les chercheurs ont en effet constaté que l’ERX-41 est efficace sur d’autres cancers associés à un stress accru du réticulum endoplasmique, tels que les cancers du pancréas et des ovaires difficiles à traiter et le glioblastome, un cancer cerveau particulièrement agressif.