Alors que la sclérose en plaques demeure aujourd’hui incurable, une équipe de neuroscientifiques de l’Université de Virginie a fait une découverte majeure, qui pourrait changer la vie des malades. Ils ont en effet identifié le récepteur cellulaire qui provoque la réponse auto-immune et la neuroinflammation caractéristiques de la maladie. Il pourrait s’agir d’une nouvelle cible de choix pour la mise au point de nouveaux traitements.
La sclérose en plaques (SEP) est une maladie auto-immune chronique, au cours de laquelle les lymphocytes T s’attaquent à la myéline du système nerveux central. Près de 2,3 millions de personnes dans le monde sont touchées par cette maladie. L’étiologie et la pathologie de la SEP sont liées à la fois à des facteurs génétiques et environnementaux, parmi lesquels le microbiote intestinal, qui semble jouer un rôle majeur. « La dysbiose intestinale [ndlr : un déséquilibre du microbiote] est une caractéristique de la maladie chez les patients atteints de SEP et dans les modèles animaux expérimentaux de SEP », notent les chercheurs dans PLOS Biology.
Divers suppléments bactériens ont donc été testés sur des modèles murins de SEP, et de nombreux candidats potentiels ont été identifiés. « En modulant le microbiote, nous progressons dans la compréhension de la manière dont la réponse immunitaire peut devenir incontrôlable dans l’auto-immunité », ont déclaré les chercheurs. Cependant, les mécanismes d’action restent flous et une meilleure compréhension de l’interaction entre le système immunitaire et le microbiote est nécessaire pour exploiter ces résultats. Le récepteur d’aryl hydrocarbone (AhR) est apparu comme un candidat de choix pour comprendre cette interaction.
Des métabolites qui entraînent la mort des cellules T
Le récepteur d’aryl hydrocarbone est un récepteur cytoplasmique et un régulateur du système immunitaire présent dans les « tissus barrières », tels que l’intestin, où il se lie à diverses molécules. Il peut ainsi être activé (ou désactivé) par une variété de ligands non pathogènes présents dans ces tissus. Il est connu pour être directement lié à la SEP. Mais son rôle dans les lymphocytes T CD4+ — les cellules immunitaires qui détruisent la myéline dans le cas de la SEP — n’avait jusqu’à présent jamais été décrit.
Or, les chercheurs ont découvert que ce régulateur est capable de reprogrammer le microbiote intestinal afin de promouvoir une inflammation chronique et nocive. Pour parvenir à cette conclusion, ils ont volontairement bloqué l’activité de l’AhR dans les cellules T CD4+ de modèles murins de SEP — ou plus exactement d’encéphalomyélite auto-immune expérimentale (EAE), un modèle animal de maladie auto-immune provoquée par une inflammation du système nerveux central. Une fois ce récepteur désactivé, l’inflammation a diminué et les souris se sont rétablies !
Les chercheurs rapportent « un effet spectaculaire sur la production d’acides biliaires et d’autres métabolites dans les microbiomes des souris de laboratoire », ayant entraîné une apoptose accrue des cellules T. Concrètement, la désactivation du récepteur a entraîné la production de métabolites ayant un impact sur la viabilité des cellules T, tels que les acides biliaires et un sous-ensemble d’acides gras à chaîne courte — l’équipe rapporte en particulier des niveaux élevés d’acide isovalérique et d’acide taurocholique.
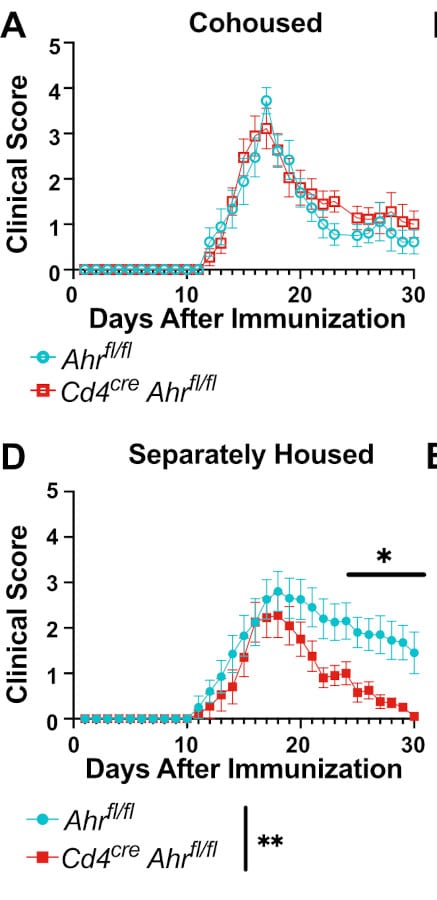
Les souris, toutes hébergées dans le même environnement dans un premier temps, n’ont montré aucune différence dans le score clinique de l’EAE lorsque l’expression de AhR a été retirée des cellules CD4+ (par rapport aux souris témoins). Aucune différence n’a non plus été observée dans la teneur en myéline de la moelle épinière. Mais lorsque les souris ont été séparées des souris témoins (à l’âge de 3 semaines) et que les chercheurs ont induit l’EAE entre 8 et 16 semaines, les souris dépourvues d’expression de l’AhR dans les cellules T présentaient « une récupération significative par rapport aux animaux de type sauvage ».
Une récupération dépendante du microbiote
« La suppression de l’AhR dans les cellules CD4 + peut favoriser la récupération de l’EAE chronique tout en n’ayant aucun impact sur l’apparition ni l’ampleur initiale de la maladie. Nous montrons en outre que ce phénotype dépend du microbiote, car la cohabitation des souris annule la récupération », résume l’équipe.
Une approche similaire pourrait donc être envisagée pour interrompre l’inflammation chez les personnes atteintes de SEP ou d’autres maladies auto-immunes. « En raison de la complexité de la flore intestinale, les probiotiques sont difficiles à utiliser en clinique. Ce récepteur peut facilement être ciblé par des médicaments, de sorte que nous avons peut-être trouvé une voie plus fiable pour promouvoir un microbiote intestinal sain », a déclaré Andrea Merchak, doctorante en neurosciences et co-auteure de l’étude. Avant cela, des recherches beaucoup plus poussées devront être menées pour bien saisir les différentes interactions entre le microbiote et le système immunitaire.
La sclérose en plaques est une maladie qui cause des spasmes et des douleurs musculaires, une certaine raideur, des difficultés à se mouvoir et des problèmes visuels, sans oublier un impact psychologique certain. Il n’existe malheureusement pas de traitement curatif. Les traitements existants permettent de contrôler les poussées, de limiter les douleurs et de ralentir la progression de la maladie. Ces immunosuppresseurs s’accompagnent malheureusement d’effets secondaires parfois sévères.