Des chercheurs de l’Université Waseda et de l’Université de Yamanashi au Japon ont mis au point un prototype de batterie solide à air, en utilisant un électrolyte solide et des molécules organiques pour remplacer les métaux traditionnels. Ce concept vise à améliorer la durabilité et la sécurité des batteries, sans oublier les performances. Il pourrait aboutir à la production de batteries plus durables destinées à nos appareils électroniques et ainsi contribuer à la transition vers le zéro carbone.
Les batteries à air représentent une avancée majeure dans le monde de l’énergie portable. Ces dispositifs exploitent l’oxygène de notre atmosphère pour générer de l’électricité. Lors de la décharge, l’oxygène ambiant est capté et intervient dans une réaction chimique au niveau de la cathode de la batterie, libérant ainsi de l’énergie. Une application courante de cette technologie réside dans les accumulateurs métal-air. Dans ces batteries, l’anode est généralement fabriquée à partir d’un métal. Elles sont souvent dotées d’un électrolyte sous forme liquide.
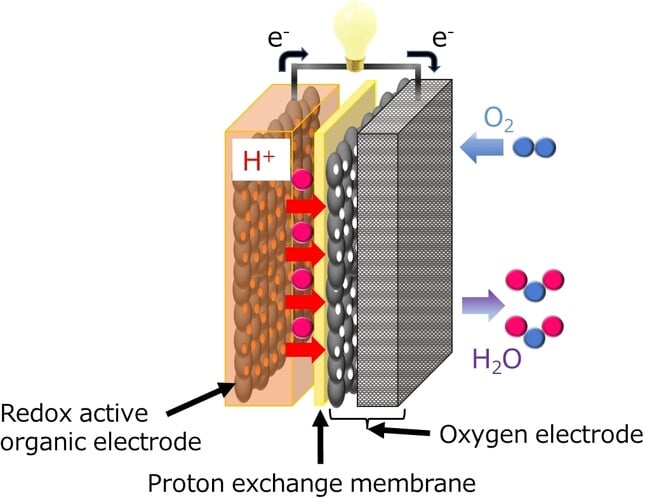
Cependant, plutôt que de s’en tenir à la norme, des chercheurs japonais ont envisagé une approche différente. Au lieu d’utiliser un métal comme composant principal de l’anode, ils ont introduit des molécules organiques. Ils ont également remplacé l’électrolyte liquide habituel par un électrolyte solide. La batterie ainsi obtenue est dite « batterie solide à air rechargeable à semi-conducteurs » (ou SSAB pour all-solid-state rechargeable air battery). Les détails du prototype ont été publiés sur le serveur Wiley Online Library.
DHBQ, PDBM et Nafion
Au cœur de chaque batterie se trouve ce que l’on appelle un « matériau actif pour électrode ». Ce composant crucial est le protagoniste des réactions chimiques qui se déroulent lorsqu’une batterie est chargée ou déchargée. Traditionnellement, les métaux ont été le choix de prédilection pour servir de matériaux actifs, en particulier pour l’anode.
Dans leur approche, les chercheurs ont opté pour des molécules organiques dotées d’une capacité redox, pour remplacer ces métaux. Leur choix s’est porté sur une molécule spécifique, la 2,5-dihydroxy-1,4-benzoquinone (DHBQ), ainsi que sur sa version polymère, le poly(2,5-dihydroxy-1,4-benzoquinone-3,6-méthylène) (PDBM). Ces molécules ont été choisies pour une raison bien précise : elles présentent des réactions redox qui sont non seulement stables, mais aussi réversibles, et ce, même dans un environnement acide. Pour l’électrolyte (cette substance qui permet aux ions de se déplacer à l’intérieur de la batterie), l’équipe a utilisé un polymère solide appelé Nafion.
Performances et potentiel de la SSAB
L’une des premières observations notables des chercheurs concernait la robustesse de la nouvelle batterie face à certains éléments. Alors que les batteries à air conventionnelles, dotées d’une électrode négative (anode) métallique et d’un électrolyte liquide montrent des signes de dégradation en présence d’eau et d’oxygène, cette nouvelle conception a démontré une résilience impressionnante face à ces deux molécules.
Lorsqu’il s’agit de la capacité de décharge électrique, le matériau PDBM a surpassé le DHBQ. Avec une capacité de décharge de 176,1 mAh par gramme, le PDBM a largement surpassé le DHBQ, qui n’a atteint que 29,7 mAh à une densité de courant constante de 1 mA cm-2. Cependant, après 30 cycles d’utilisation, la batterie PDBM a vu sa capacité chuter à 44%. Mais pour pallier ce problème, les chercheurs ont augmenté la quantité de nafion, permettant ainsi de remonter cette capacité à 78% après 30 cycles.
Une capacité coulombique plus élevée
La capacité coulombique est un autre indicateur essentiel de la performance d’une batterie. Elle illustre le rapport entre l’énergie que l’on peut extraire d’une batterie lors de sa décharge et l’énergie qu’elle a emmagasinée lors de sa charge. Plus simplement, c’est comme comparer l’énergie introduite dans une batterie à celle retirée. On peut également considérer cela comme un rendement.
Pour la batterie PDBM, les résultats étaient prometteurs. À un taux de 4 C (ce qui signifie que la batterie serait complètement déchargée en 15 minutes), l’efficacité coulombique était de 84%. Cependant, à un taux plus élevé de 101 C (moins d’une minute pour une décharge complète), cette efficacité est passée à 66%. Cette observation indique que, bien que la batterie performe bien à des vitesses de décharge modérées, elle pourrait être moins efficace lorsqu’elle est sollicitée à des taux plus élevés.

