Trouver le moyen de régénérer un membre perdu demeure du domaine de la science-fiction. Mises à part les salamandres et quelques autres espèces, aucun organisme n’est capable de régénération tissulaire spontanée. Néanmoins, un tel remède permettrait d’améliorer le quotidien des millions de personnes dans le monde qui ont perdu un membre suite à un accident ou une maladie. Dans ce contexte, des chercheurs de l’Université Tufts annoncent avoir réussi à faire repousser la patte d’une grenouille, en lui administrant un mélange de médicaments bien spécifique via un bioréacteur.
Les têtards et les jeunes grenouilles ont la capacité de régénérer leurs membres postérieurs, mais cette capacité disparaît à l’âge adulte. Pourtant, des chercheurs ont pu déclencher la repousse d’une patte perdue à l’aide d’un cocktail de cinq médicaments, administré via un bioréacteur portable en silicone, directement appliqué sur la souche du membre pendant seulement 24 heures. Le traitement a entraîné la repousse de la patte, qui est devenue complètement fonctionnelle au bout de 18 mois.
« Le fait qu’il n’ait fallu qu’une brève exposition aux médicaments pour déclencher un processus de régénération de plusieurs mois suggère que les grenouilles et peut-être d’autres animaux peuvent avoir des capacités de régénération dormantes qui peuvent être déclenchées », souligne dans un communiqué Nirosha Murugan, chercheuse affiliée au Allen Discovery Center de l’Université Tufts et auteure principale de l’article relatant l’expérience. Non seulement la patte a repoussé, mais elle bougeait et répondait aux stimuli comme n’importe quel autre membre de l’animal.
Un cocktail anti-inflammatoire qui favorise la croissance des tissus
Nous connaissons peu d’espèces capables de régénération complète d’un membre. Les salamandres apparaissent comme les championnes de cette catégorie et de ce fait, intéressent énormément les chercheurs en médecine régénérative. Grâce à une voie métabolique appelée extracellular signal-regulated kinases (ERK), permettant aux cellules de se reprogrammer, ces amphibiens sont capables de régénérer non seulement un membre, mais aussi des structures plus complexes comme le cœur, les yeux ou la moelle épinière. Les étoiles de mer, les crabes, ou encore les lézards, ont eux aussi la capacité de régénérer complètement un membre perdu.
L’être humain dispose de capacités régénératives bien moins étendues. Notre organisme est capable de créer de nouveaux tissus pour refermer les plaies et notre foie possède la capacité de reconstituer des parties qui lui ont été enlevées — même lorsque son volume est réduit de près de moitié après une intervention chirurgicale par exemple.
La régénération d’un membre (constitué de peau, d’os, de vaisseaux sanguins, de nerfs et de muscles) est autrement plus complexe. D’autant plus que notre organisme réagit en recouvrant les blessures graves de tissu cicatriciel amorphe, qui ne permet aucune croissance ultérieure.
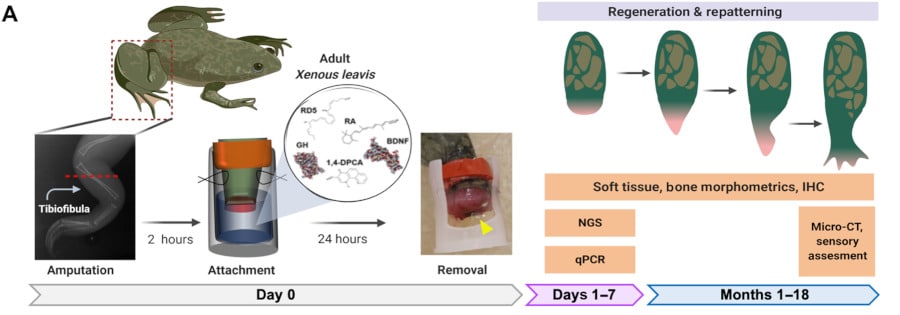
Tout comme l’Homme, une grenouille adulte ne peut espérer qu’un membre perdu se reconstitue de lui-même. Mais une équipe de chercheurs a réussi à enclencher le processus en enfermant la plaie dans un BioDome (une sorte de petit capuchon en silicone) contenant un hydrogel de soie (servant de substrat à libération contrôlée) chargé d’un mélange de cinq médicaments, chacun ayant un rôle bien défini. « Nous avons cherché à utiliser des composés susceptibles de déclencher une cascade morphogénétique endogène durable, sans intervention ultérieure ou microgestion continue, en choisissant une variété de composés qui induiraient des processus complémentaires tels que la modulation de l’inflammation, la promotion de l’épargne neurale et la croissance tissulaire », détaillent les chercheurs dans leur étude.
En d’autres termes, il s’agissait d’atténuer l’inflammation et d’inhiber la production de collagène (pour éviter que les tissus cicatrisent), tout en dopant la croissance des fibres nerveuses, des vaisseaux sanguins et des muscles.
Imiter un environnement de type amniotique
Comment a agi le BioDome exactement ? Les chercheurs rapportent avoir détecté l’activation de voies moléculaires connues, qui sont habituellement utilisées lors de la phase embryonnaire, lorsque l’organisme se développe et prend forme. Chez les grenouilles amputées et traitées, la patte a complètement repoussé et retrouvé presque toutes ses capacités. Les animaux traités ont présenté un retard marqué de la cicatrisation de la plaie par rapport aux animaux amputés non traités, suivi de résultats de croissance à long terme (18 mois). Les chercheurs ont par ailleurs observé une augmentation significative de la croissance des tissus mous dès 2 semaines après l’amputation, qui s’est maintenue tout au long de la période de croissance.
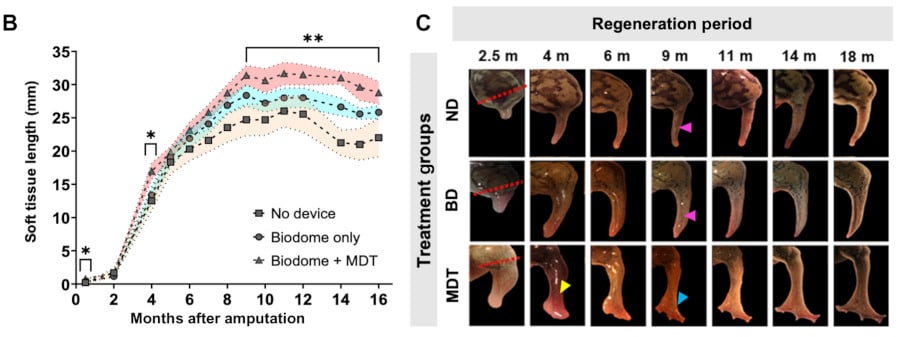


En outre, la nouvelle patte affichait une structure osseuse étendue, avec des caractéristiques similaires à la structure osseuse d’un membre naturel, et comportait davantage de neurones. Le nouveau membre bougeait et répondait à des stimuli externes (tels que le toucher d’une fibre rigide) ; les grenouilles pouvaient s’en servir pour nager, se déplaçant comme n’importe quelle grenouille. Fait intéressant : les grenouilles amputées qui ont bénéficié d’un BioDome non additionné de médicaments présentaient une sensibilité accrue au niveau de la zone blessée, par rapport aux grenouilles amputées qui n’ont pas bénéficié du dispositif.
La plupart des espèces capables de régénération vivent en milieu aquatique ; en cas de blessure, des cellules souches cutanées apparaissent rapidement et recouvrent la plaie de manière à protéger le tissu en reconstruction. Dans le cas des animaux terrestres, les blessures sont exposées à l’air ou en contact direct avec le sol, ce qui ralentit le processus de cicatrisation. « Couvrir la plaie ouverte avec un environnement liquide sous le BioDome, avec le bon cocktail de médicaments, pourrait fournir les premiers signaux nécessaires pour déclencher le processus de régénération », explique le professeur Michael Levin, directeur du Allen Discovery Center et co-auteur de l’étude.
L’équipe envisage de mener une étude plus approfondie des combinaisons de médicaments et des facteurs de croissance qui pourraient provoquer la repousse spontanée des membres, afin d’appliquer un jour cette approche à des mammifères, voire à l’Homme. Selon eux, il s’agit non pas de créer de nouveaux processus de croissance, mais simplement de « réveiller » des programmes de structuration anatomique dont disposent tous les animaux adultes, mais qui tombent malheureusement en sommeil une fois la croissance terminée.


