Comment un métal se forme-t-il et est-il chimiquement défini ? C’est à cette question fondamentale que l’étudiant Ryan McMullen souhaite répondre dans son sujet de thèse lorsqu’il contacte Stephen Bradforth, professeur de chimie à l’USC Dornsife College of Letters, Arts and Sciences. L’expérience proposée par McMullen est coûteuse et techniquement dangereuse ; divers directeurs de laboratoire rejettent sa proposition, mais Bradforth, lui, décide de lui donner sa chance. Il réunit une équipe de chercheurs et modifie son propre laboratoire pour y intégrer les normes de sécurité nécessaires. Et l’expérience conduite par l’équipe a produit des résultats extrêmement importants dans le domaine des métaux.
Le projet s’est donc penché sur une question fondamentale : quelles propriétés sont inhérentes à un métal et lesquelles sont accessoires ? L’effort en valait la peine. L’expérience a révélé des découvertes qui sont « le genre de choses qui se trouvent dans les manuels, ou du moins modifient la façon dont les manuels sont écrits », déclare Bradforth, notant l’importance potentiellement historique du travail.
L’intuition suggère que les métaux sont denses, et bien que cela soit vrai pour certains, cela ne s’applique pas à d’autres. Par exemple, le lithium — couramment utilisé dans les batteries — flotte sur l’eau. Certains métaux sont durs, comme le titane, mais d’autres cèdent facilement à la pression, notamment l’indium et l’aluminium. Et la température de fusion ? Le platine fond à plus de 1700 °C, mais le mercure est un liquide bien en dessous de zéro.
Le rôle des électrons solvatés dans la formation des métaux
Contrairement à la densité ou à la dureté, la conduction est une propriété inhérente à tous les métaux. Cherchant à mieux comprendre les propriétés intrinsèques des métaux, Bradforth, McMullen et leurs collègues ont utilisé une astuce notée pour la première fois par le chimiste Sir Humphry Davy en 1809. En substance, ils ont fabriqué un métal à partir de zéro. Les chimistes ont refroidi l’ammoniac — normalement un gaz à température ambiante — à moins 33 °C pour le liquéfier, puis ont ajouté, dans des expériences distinctes, les métaux alcalins lithium, sodium et potassium.
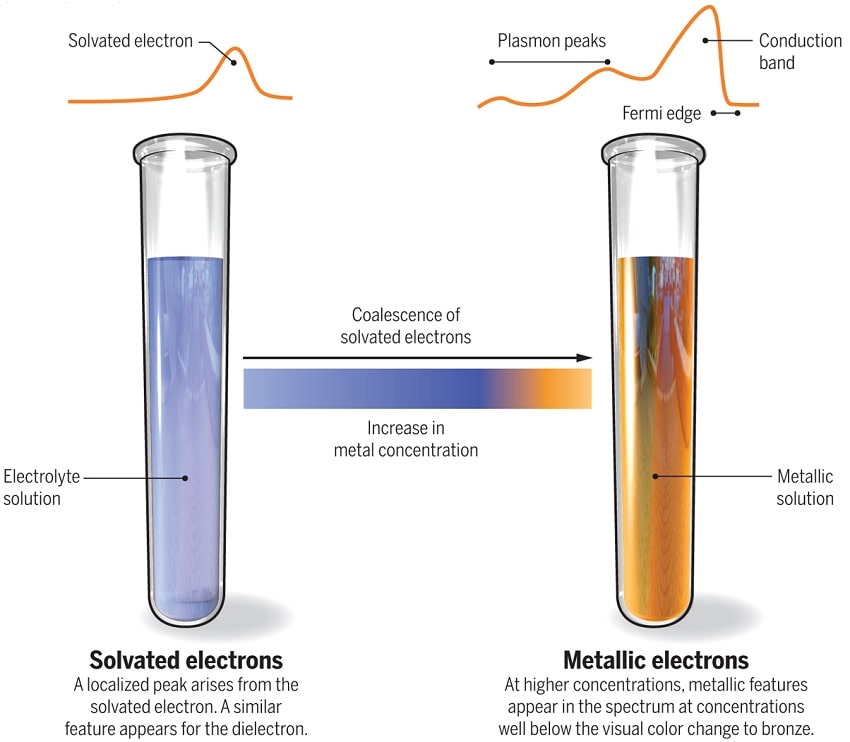
Dans ces solutions, les électrons du métal alcalin sont initialement piégés dans les espaces entre les molécules d’ammoniac. Cela crée ce que les scientifiques appellent des « électrons solvatés », qui sont très réactifs mais stabilisés dans l’ammoniac. Ces solutions ont une couleur bleue caractéristique. Mais en ajoutant suffisamment d’électrons solvatés, le liquide entier devient couleur bronze et, essentiellement, devient un métal tout en restant liquide.
Les électrons dissous se sont révélés importants pour les chimistes. Grâce à une réaction appelée « réduction de Birch », du nom du chimiste Arthur Birch, ils ont joué un rôle clé dans la synthèse de nombreux composés importants et ont conduit à la fabrication de contraceptifs oraux dans les années 1950.
Sur le même sujet : Des « métaux étranges » révèlent un tout nouveau type de conduction électrique
Un modèle d’énergie caractéristique des métaux
Les chercheurs ont ensuite mesuré la quantité d’énergie nécessaire pour faire sortir les électrons solvatés de l’ammoniac métallique à l’aide d’un faisceau de rayons X extrêmement lumineux et concentré, basé à Berlin. Dans une toute première expérience, ils ont forcé différentes concentrations d’ammoniac métallique à travers un microjet, ce qui a créé un flux d’environ la largeur d’un cheveu humain qui a ensuite traversé un faisceau de rayons X très fin.
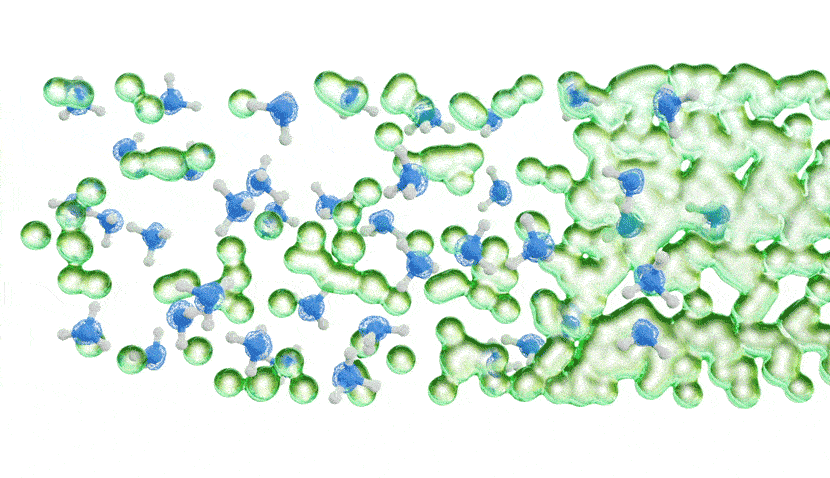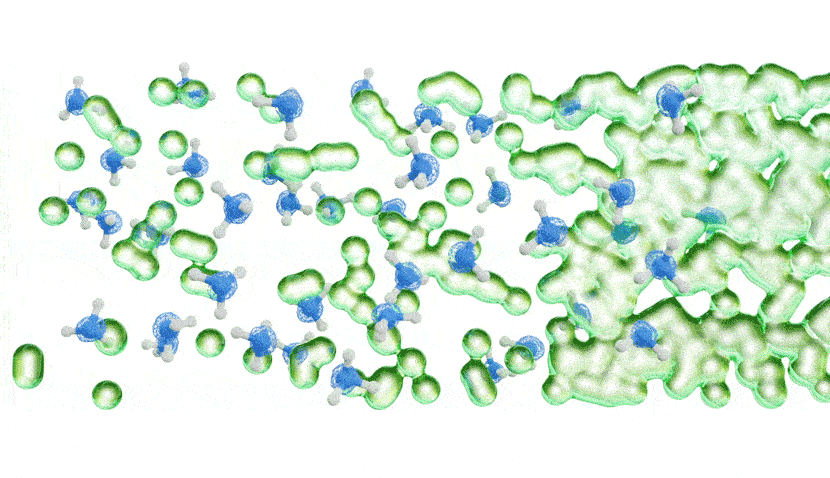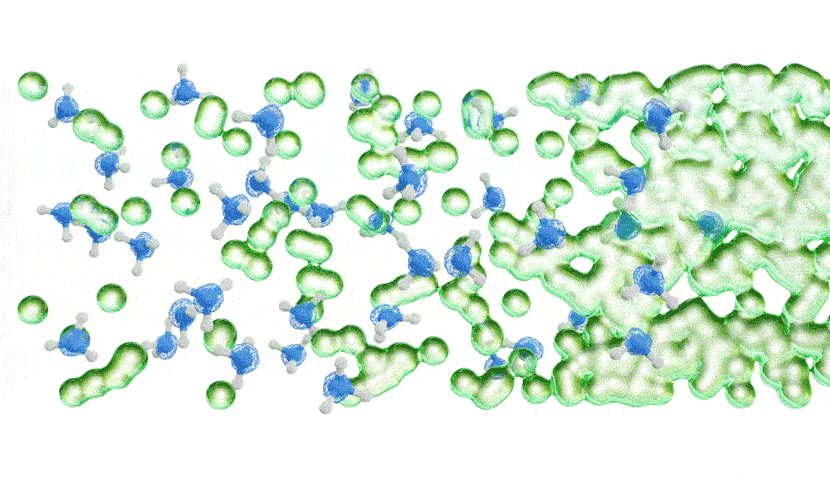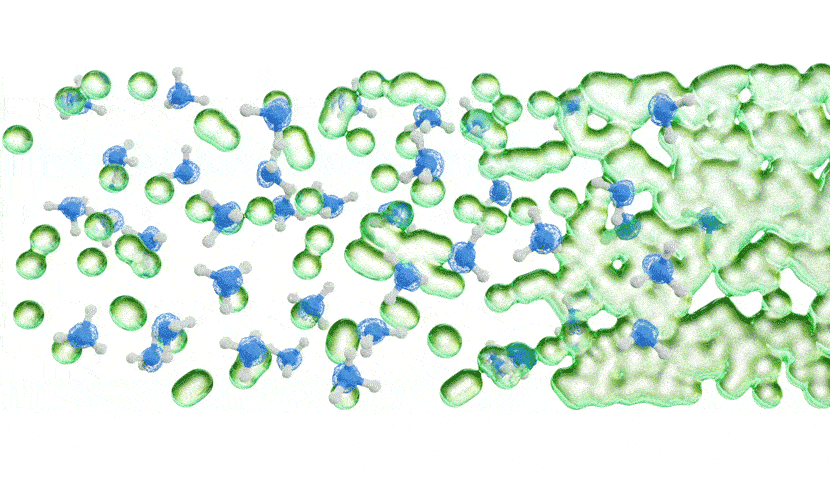
Les résultats ont montré qu’à de faibles concentrations, les électrons solvatés étaient plus facilement délogés de la solution par l’interaction avec les rayons X, donnant un modèle d’énergie simple. À des concentrations plus élevées, cependant, le modèle d’énergie a soudainement développé un bord de bande caractéristique, indiquant que la solution se comportait comme le ferait un métal.
Bien que les implications pratiques du résultat nécessitent des recherches supplémentaires, l’expérience ouvre une nouvelle fenêtre pour les chimistes pour synthétiser des composés organiques importants. Tout comme la réduction de Birch a conduit aux contraceptifs oraux, cette expérience pourrait également conduire à de nouveaux composés à utiliser d’un nombre incalculable de façons.
Vidéo expliquant le travail des chercheurs :


 L’électron est une particule élémentaire qui, avec les protons et les neutrons, constitue les atomes. C’est donc l’un des composants principaux de la matière baryonique. À ce titre, il revêt... [...]
L’électron est une particule élémentaire qui, avec les protons et les neutrons, constitue les atomes. C’est donc l’un des composants principaux de la matière baryonique. À ce titre, il revêt... [...]