Le lupus érythémateux disséminé (ou lupus systémique) est une maladie chronique auto-immune, qui induit la formation d’auto-anticorps anti-ADN double brin et d’autres anticorps antinucléaires, conduisant à l’inflammation de plusieurs organes (reins, cœur, poumons, peau). Des chercheurs allemands ont testé avec succès une nouvelle thérapie basée sur des cellules T génétiquement modifiées sur cinq patients atteints de cette maladie. Ces résultats ouvrent la voie au traitement d’autres maladies auto-immunes, telles que la sclérose en plaques.
Le lupus érythémateux disséminé (LED) concerne 0,1% de la population, majoritairement les jeunes femmes. Cette maladie peut toucher les articulations, les reins, la peau, les muqueuses et les parois des vaisseaux sanguins. Les causes de ce dérèglement immunitaire restent inconnues, même si certains facteurs favorisants ont été identifiés (des facteurs hormonaux et génétiques, certains médicaments, des infections virales, etc.). Les patients sont généralement traités avec de l’hydroxychloroquine, des corticoïdes et d’autres médicaments immunosuppresseurs.
Une équipe de chercheurs allemands a utilisé une thérapie révolutionnaire pour traiter cette maladie auto-immune, nommée « Chimeric Antigen Receptor (CAR)-T cells » : elle consiste à collecter les lymphocytes T du patient — des cellules essentielles à la réponse immunitaire adaptative — et à les modifier de sorte qu’elles attaquent de nouvelles cibles lorsqu’elles sont réinjectées dans l’organisme. Testée sur cinq patients, cette approche a montré des résultats spectaculaires : tous sont en rémission et n’ont plus besoin de médicaments contre le lupus. Les chercheurs évoquent une véritable « réinitialisation du système immunitaire ».
Disparition des symptômes en trois mois
La thérapie par cellules T à récepteur antigénique chimérique est une approche d’immunothérapie en plein développement, mise en oeuvre initialement pour traiter certains cancers. Elle repose sur la modification génétique des propres lymphocytes T du patient, afin qu’ils expriment à leur surface une protéine chimérique (créée artificiellement) spécifique — l’objectif étant qu’ils soient en mesure de reconnaître et détruire les cellules cancéreuses.
Concrètement, il s’agit d’introduire au sein du génome des lymphocytes T un nouveau gène qui conduit à la production de cette protéine. Une fois ces cellules T modifiées, elles sont réinjectées dans le corps du patient. Depuis sa première utilisation en 2015, cette approche s’est montrée efficace contre plusieurs types de cancers, en particulier les cancers du sang (et plus récemment contre les cancers du système digestif).
Dans le cas du traitement des lymphomes, la protéine ajoutée cible le récepteur CD19 présent à la surface des lymphocytes B — les cellules qui sont à l’origine de la maladie. Dans le cas du lupus, la cible est la même, car ce sont les cellules B qui produisent les auto-anticorps s’attaquant aux tissus sains de l’organisme.
Cinq patients âgés de 18 à 24 ans, atteints de LED (quatre femmes et un homme) depuis un à neuf ans et réfractaires à plusieurs traitements médicamenteux immunosuppresseurs, ont été recrutés pour tester cette nouvelle thérapie. Au fil du temps, la maladie a affecté plusieurs organes chez ces cinq patients, mais après la thérapie, les symptômes graves, comme l’arthrite, la fatigue, la fibrose des valves cardiaques et l’inflammation pulmonaire, ont tous disparu.
Une thérapie ciblée, qui n’affecte pas les défenses immunitaires
Des tests sanguins ont révélé que la thérapie avait permis d’éliminer toutes les cellules B dysfonctionnelles : quatre mois après le traitement, le niveau de cellules B est revenu à la normale, mais elles ne produisaient plus d’anticorps néfastes. L’état des patients s’était considérablement amélioré. « Les cellules T-CAR expansées in vivo ont entraîné une déplétion profonde des cellules B, une amélioration des symptômes cliniques et une normalisation des paramètres de laboratoire, notamment la séroconversion des anticorps anti-ADN double brin », résument les chercheurs dans Nature Medicine.
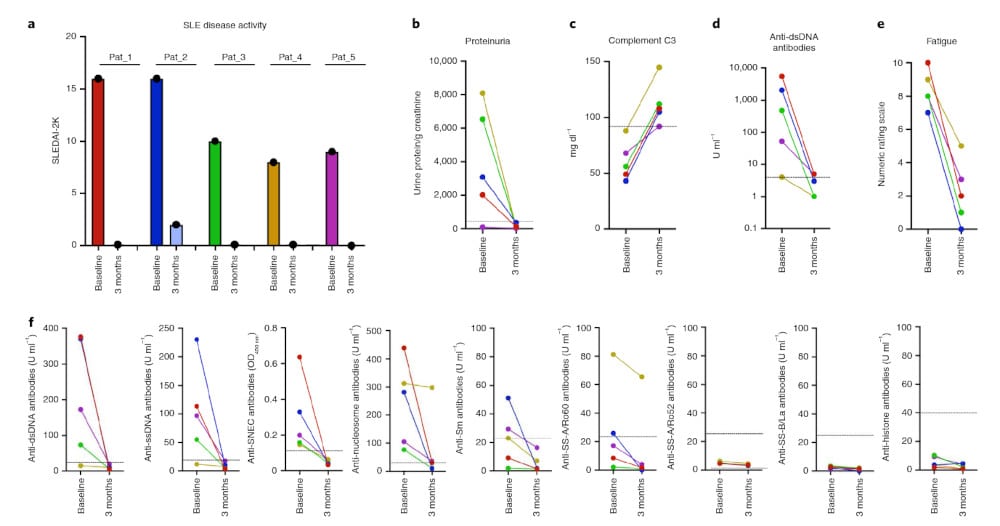


Le traitement par cellules T-CAR a été bien toléré avec seulement un léger syndrome de libération de cytokines, notent les chercheurs. Une rémission était observable chez les cinq patients dès trois mois après le traitement et s’est maintenue, sans médicament, pendant un suivi plus long (jusqu’à 18 mois pour le premier patient traité). L’équipe ne sait pas encore combien de temps durera cette rémission et continue à suivre les participants à l’essai.
Les chercheurs ont également vérifié si la thérapie n’avait pas compromis l’efficacité du système immunitaire vis-à-vis d’autres infections ; pour ce faire, ils ont comparé la réponse des patients à plusieurs vaccins standards (ROR, DTP, hépatite B) avant et après le traitement. Ils n’ont pas observé de déclin substantiel de la réponse immunitaire après la thérapie — ce qui indique qu’elle ciblait principalement les cellules B productrices d’auto-anticorps et non les cellules productrices d’immunoglobulines dans leur ensemble.
« Ces données suggèrent que le transfert de cellules T-CAR CD19 est faisable, tolérable et très efficace dans le LED », conclut l’équipe. Reste à déterminer la durée de la rémission et les conditions dans lesquelles la thérapie a le plus de chances de fonctionner ; en effet, les symptômes et la gravité du lupus varient d’une personne à l’autre et il se pourrait que cette thérapie soit plus utile aux premiers stades de la maladie. En attendant de plus amples recherches, les résultats de cet essai suscitent l’espoir de venir à bout d’autres maladies auto-immunes telles que la polyarthrite rhumatoïde et la sclérose en plaques.