Des chercheurs ont identifié un cocktail d’enzymes produit par une bactérie du microbiote intestinal capable d’éliminer les antigènes A et B des groupes sanguins et produire ainsi du sang universel. Les enzymes agiraient également sur leurs variantes reconnues depuis peu comme déterminantes pour la sécurité des transfusions sanguines. Bien que les résultats soient encore préliminaires, l’approche pourrait améliorer considérablement l’accès aux dons de sang universel.
Chez les humains, les quatre groupes sanguins sont déterminés par des antigènes spécifiques (ABO A, B, AB et O) présents à la surface des globules rouges. Récemment, des variantes comportant des extensions glucidiques spécifiques ont également été identifiées. La compatibilité entre les donneurs et les receveurs pour les transfusions sanguines et les dons d’organes dépend de ces antigènes. Si les groupes sanguins ne correspondent pas, cela enclenche une réponse immunitaire potentiellement mortelle chez le receveur.
Afin d’anticiper les besoins, chaque don de sang est analysé par les laboratoires pour identifier ces antigènes, ainsi que d’éventuels marqueurs pathologiques et traces de toxines. Cependant, il existe actuellement une pénurie mondiale de sang de donneur en raison du vieillissement de la population mondiale et de l’augmentation de la demande — sans compter que les poches de sang ne se conservent que 42 jours au maximum.
Afin d’y remédier, les recherches se concentrent sur la conversion enzymatique des antigènes A et B vers le groupe O. Le groupe O n’exprime que les antigènes précurseurs de A et B (antigènes H) et peut ainsi être un donneur universel. La conversion de ces deux groupes sanguins permettrait de réduire considérablement les coûts et la logistique liés au prélèvement et au stockage de dons de sang de quatre groupes différents. De plus, l’augmentation des dons de sang universel réduirait le gaspillage lié aux incompatibilités.
« Lorsque nous pourrons créer du sang ABO universel, nous simplifierons la logistique de transport et d’administration de produits sanguins sûrs, tout en minimisant le gaspillage de sang », explique dans un communiqué de l’Université Technique du Danemark (DTU), Martin L. Olsson, de l’Université de Lund en Suède.
Dans cette vision, différentes enzymes ont été identifiées pour éliminer efficacement les antigènes A et B. En effet, la conversion enzymatique des antigènes sanguins a été proposée il y a plus de 40 ans. Cependant, des problèmes d’incompatibilité inexpliqués persistent, entravant ainsi leur application clinique. Olsson et ses collègues du DTU proposent un nouveau cocktail enzymatique qui pourrait enfin permettre de surmonter ces obstacles.
Bientôt des donneurs universels du groupe B ?
Afin d’identifier de nouvelles enzymes pouvant cibler les antigènes A et B, les chercheurs de la nouvelle étude se sont concentrés sur celles produites par l’Akkermansia muciniphila. Il s’agit d’une bactérie présente naturellement dans notre microbiote intestinal et qui se nourrit des molécules glucidiques complexes présentes au niveau de la muqueuse intestinale. Parmi ces molécules figurent des composés dont la structure est étroitement similaire à celle des antigènes A et B à la surface des globules rouges. Les chercheurs ont alors émis l’hypothèse selon laquelle les enzymes de la bactérie pourraient également les dégrader.
« La particularité de la muqueuse est que les bactéries capables d’y vivre disposent souvent d’enzymes spécialement conçues pour dégrader les molécules glucidiques du mucus qu’elle sécrète, parmi lesquelles figurent les antigènes du groupe sanguin ABO », explique Maher Abou Hachem du DTU, qui a codirigé l’étude — publiée dans la revue Nature Microbiology. Une récente recherche distincte suggère d’ailleurs qu’A. muciniphila est impliquée dans l’hématopoïèse extramédullaire, un mécanisme visant à compenser l’insuffisance de production de cellules sanguines.
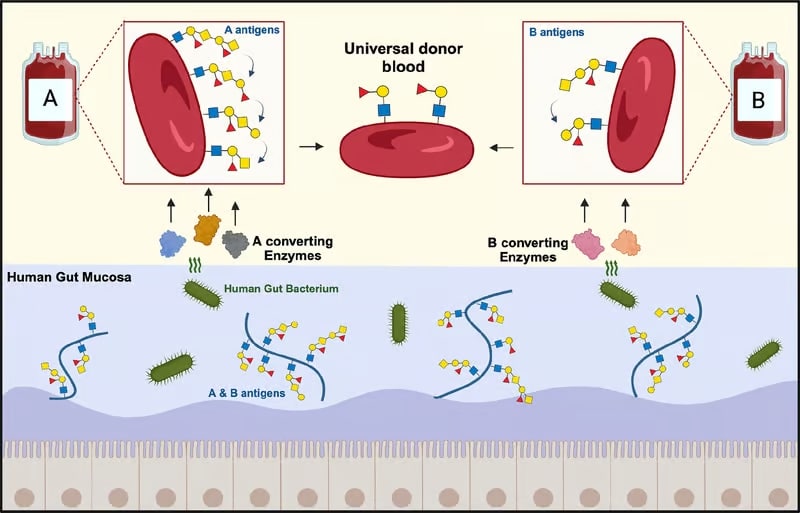
Afin mettre à l’épreuve leur hypothèse, les chercheurs ont testé 24 enzymes différentes produites par la bactérie, pour traiter des centaines d’échantillons de sang. Contrairement aux études précédentes, les essais ont été réalisés dans des conditions douces et sans additifs pour stimuler l’activité enzymatique — ce qui en améliore la viabilité clinique.
Ils ont ainsi constaté que deux mélanges d’enzymes étaient particulièrement efficaces pour dégrader non seulement les antigènes A et B conventionnels, mais également les variantes étendues récemment décrites — une première pour ce type de procédé. Selon les estimations de l’équipe, environ 18 et 8 mg d’enzymes sont suffisants pour convertir une unité (environ 200 ml) de globules rouges A et B (respectivement).
« Pour la première fois, les nouveaux cocktails enzymatiques éliminent non seulement les antigènes A et B, mais également la plupart des variantes étendues qui n’étaient auparavant pas reconnues comme problématiques pour la sécurité transfusionnelle », indique Abou Hachem.
Toutefois, alors que les résultats suggèrent qu’il est bientôt possible de produire du sang universel à partir de donneurs du groupe B, davantage de recherches sont nécessaires pour la conversion du groupe A, qui est plus complexe, ont précisé les experts. Par ailleurs, la présente étude ne fait pas état des interactions éventuelles des enzymes avec le facteur Rhésus, qui, lui aussi, est déterminant pour la sécurité des transfusions.
Néanmoins, les chercheurs prévoient d’explorer plus avant les éventuels obstacles au cours des trois prochaines années, avant de passer aux essais cliniques. Une demande de brevet a déjà été déposée pour leur cocktail d’enzyme et leur protocole de traitement. « Notre objectif est maintenant d’étudier en détail s’il existe d’autres obstacles et comment nous pouvons améliorer nos enzymes pour atteindre l’objectif ultime d’une production universelle de sang », conclut Abou Hachem.