Une étude révèle que le cœur possède son propre « mini-cerveau », un réseau neuronal complexe régulant les fonctions cardiaques indépendamment du système nerveux central. Alors qu’on pensait initialement qu’il ne s’agissait que d’un simple système de relais, il se révélerait doté de fonctions plus avancées et jouerait un rôle clé dans le contrôle du rythme cardiaque. Cette découverte pourrait contribuer au développement de nouveaux médicaments pour les maladies cardiaques.
On a longtemps pensé que l’homéostasie cardiovasculaire est principalement régie par les interactions complexes entre les systèmes nerveux parasympathique et sympathique du système nerveux autonome. Les signaux provenant et à destination de ces systèmes sont relayés par le système nerveux intracardiaque, intégré dans les couches supérieures de la paroi cardiaque.
Cependant, bien que l’innervation centrale du cœur ait été étudiée de manière approfondie, les fonctions et la structure du système nerveux intracardiaque restent partiellement incomprises. Des études ont récemment suggéré qu’il ne s’agit pas d’un simple relais d’informations. Il a été proposé qu’il agit en tant que centre de traitement final et d’intégration des signaux du système nerveux autonome, conduisant ainsi à l’hypothèse selon laquelle il s’agit du « mini-cerveau » du cœur.
L’étude du Karolinska Institutet (en Suède) et de l’Université Columbia (aux États-Unis) étaye cette hypothèse en révélant que le système nerveux intracardiaque est bien plus complexe et diversifié qu’on le pensait. « Nous avons été surpris de constater à quel point le système nerveux du cœur est complexe », explique dans un communiqué Konstantinos Ampatzis, chercheur principal de l’étude et professeur au département de neurosciences du Karolinska Institutet, qui a dirigé la recherche. « Une meilleure compréhension de ce système pourrait éclairer les mécanismes des maladies cardiaques et permettre le développement de nouveaux traitements contre des affections telles que les arythmies », suggère-t-il.
Un rôle essentiel dans la régulation du rythme cardiaque
L’hypothèse du mini-cerveau cardiaque devrait logiquement impliquer un groupe interconnecté de neurones parasympathiques et sympathiques, de neurones sensoriels, d’interneurones régulateurs locaux et de neurones moteurs. Cette interconnexion est essentielle au contrôle local des fonctions cardiaques indépendamment du système nerveux central. Bien qu’il ait été démontré que le système nerveux intracardiaque joue un rôle dans certaines fonctionnalités telles que la contractilité, son implication dans le contrôle du rythme cardiaque était jusqu’à présent méconnue.
Pour explorer l’hypothèse, les chercheurs de la nouvelle étude ont caractérisé les neurones intracardiaques du poisson-zèbre (Danio rerio) adulte, un modèle animal dont la fréquence et la fonctionnalité cardiaque globale présentent de fortes similitudes avec celles des humains. De plus, l’animal possède un cœur composé de 4 chambres (sinus veineux, oreillette, ventricule et bulbe artériel) connectées séquentiellement par des valves, à l’instar de celui des humains.
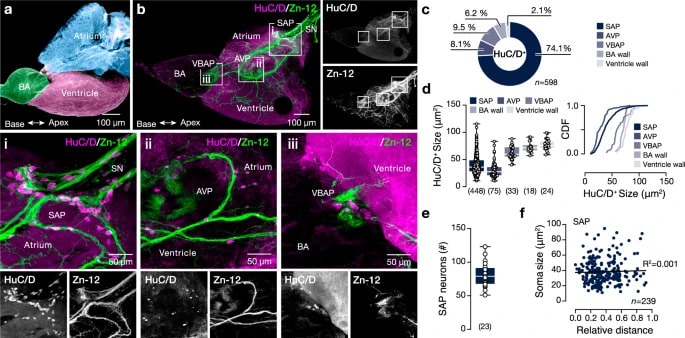
Les chercheurs ont combiné différentes méthodes, dont le séquençage d’ARN à cellule unique, l’analyse neurochimique et anatomique, ainsi que des techniques électrophysiologiques. L’objectif était de cartographier l’innervation du cœur du poisson-zèbre et de déterminer la distribution anatomique des neurones intracardiaques. « Notre stratégie expérimentale a donné lieu à une carte structurelle et fonctionnelle améliorée de la diversité neuronale au sein du système nerveux intracardiaque », écrivent-ils dans leur rapport, détaillé dans la revue Nature Communications.
Les analyses ex vivo du cœur du poisson-zèbre ont révélé plusieurs types de neurones cardiaques, chacun ayant des fonctions spécifiques. L’un des groupes présentait des propriétés de stimulateur cardiaque et joue un rôle clé dans les fonctions rythmiques telles que la respiration et la locomotion. Le plus grand groupe de neurones (74,1%) a en outre été détecté au niveau de la valve sino-auriculaire, formant le plexus sino-auriculaire, une structure essentielle à l’homéostasie du rythme cardiaque.
Ces observations remettent en question l’hypothèse conventionnelle selon laquelle le rythme cardiaque est principalement régulé par le système nerveux autonome. « Collectivement, nos résultats soutiennent le rôle crucial du système nerveux intracardiaque dans la fonctionnalité cardiaque et fournissent une base pour une meilleure compréhension de la manière dont différents types de neurones au sein du système sont impliqués dans diverses conditions physiologiques et pathologiques », indique l’équipe.
En prochaine étape, l’équipe prévoit d’étudier la manière dont le mini-cerveau du cœur interagit avec le cerveau pour réguler les fonctions cardiaques dans diverses conditions, telles que l’exercice, le stress et les conditions pathologiques. Examiner la manière dont les perturbations du système nerveux intracardiaque peuvent contribuer à différents troubles cardiaques, permettrait également d’identifier de nouvelles cibles thérapeutiques.