Des chercheurs ont développé un composé servant de « colle moléculaire » à deux protéines, qui, une fois combinées, activent le processus naturel d’autodestruction (ou apoptose) des cellules cancéreuses. Cette stratégie se distingue des autres thérapies cellulaires à la fois par sa haute spécificité et par sa capacité à activer un processus moléculaire désactivé par le cancer. Le composé a montré des résultats prometteurs lors d’essais sur des cellules de lymphome diffus à grandes cellules B.
Chaque jour, notre organisme élimine environ 60 milliards de cellules via un processus de mort cellulaire programmée, connu sous le nom d’apoptose. Ce mécanisme est essentiel pour le renouvellement cellulaire naturel (notamment des cellules sanguines et intestinales) et joue un rôle clé dans de nombreux processus biologiques, tels que le fonctionnement des organes et la régulation du système immunitaire. Il est hautement sélectif, ne détruisant que les cellules non essentielles, tout en conservant celles qui reconnaissent les agents pathogènes, évitant ainsi les maladies auto-immunes.
L’apoptose suscite un vif intérêt pour les thérapies anticancéreuses en raison de cette spécificité. En effet, les traitements classiques, tels que la chimiothérapie et la radiothérapie, attaquent à la fois les cellules saines et cancéreuses, les rendant ainsi très toxiques. L’équipe de l’Université de Stanford propose une stratégie novatrice exploitant la spécificité de l’apoptose pour cibler exclusivement les cellules cancéreuses.
« C’était la voie que nous voulions emprunter pour traiter le cancer », explique Gérald Crabtree, co-auteur principal de l’étude publiée dans la revue Science, dans un article de blog de Stanford Medicine. « Nous souhaitons reproduire cette spécificité qui élimine 60 milliards de cellules sans dommages collatéraux, assurant qu’aucune cellule ne soit détruite si elle n’est pas la cible appropriée », ajoute-t-il.
Une approche contrastant avec les thérapies cellulaires traditionnelles
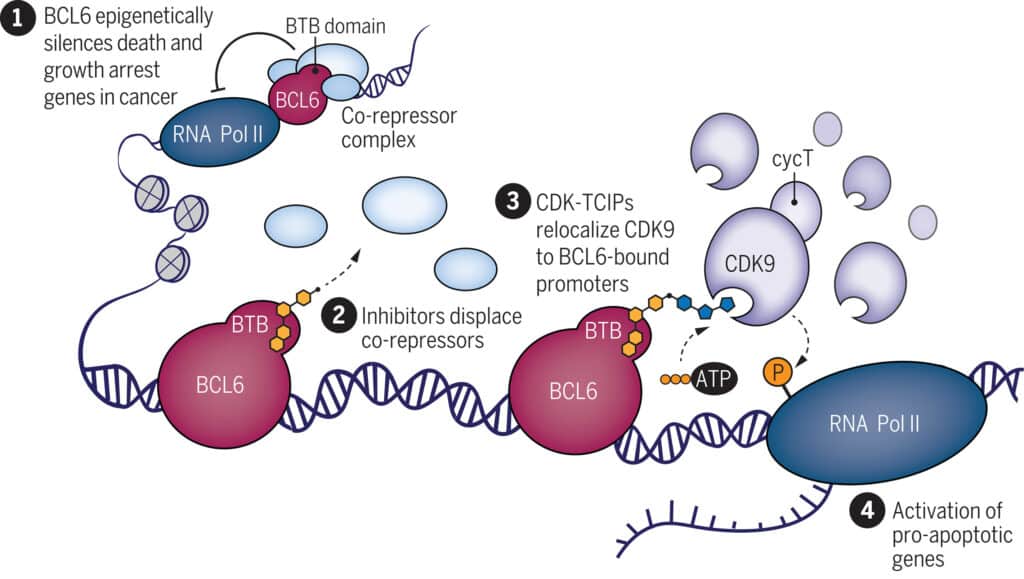
Pour exploiter l’apoptose dans l’élimination des cellules cancéreuses, les chercheurs ont conçu un inducteur chimique de proximité à petites molécules (CIP). Ce dernier agit comme une colle moléculaire, permettant de rapprocher et d’associer deux molécules qui, en temps normal, ne se lieraient pas. L’hypothèse avancée par l’équipe est que le CIP pourrait transformer les inhibiteurs de kinase en activateurs d’états transcriptionnels épigénétiquement silencieux. Autrement dit, il s’agit d’activer une voie moléculaire normalement désactivée dans les cellules cancéreuses, contrairement aux approches antérieures qui visaient à désactiver des facteurs oncogènes spécifiques.
« Depuis la découverte des oncogènes, les chercheurs tentent de les neutraliser dans le cancer », souligne Roman Sarott de Stanford Medicine, également coauteur de l’étude. « Nous essayons plutôt de les utiliser pour activer une signalisation potentiellement bénéfique pour le traitement ».
Un CIP a été développé pour lier la protéine BCL6 à la protéine kinase CDK9. BCL6, une protéine oncogène, est impliquée dans 40 à 60% des cas de lymphome diffus à grandes cellules B, souvent par mutation, surexpression ou dérégulation. La mutation de BCL6 désactive l’apoptose des cellules cancéreuses en se fixant aux gènes responsables du processus, permettant ainsi la prolifération tumorale. La CDK9, quant à elle, active ces gènes. Le CIP associe ces deux molécules, les guidant vers les gènes cibles. « Vous utilisez un élément essentiel à la survie du cancer pour inverser la situation et le détruire », explique Nathanael Gray, participant à l’étude.
Une efficacité centuplée par rapport aux thérapies précédentes
Des essais sur des cellules humaines de lymphome diffus à grandes cellules B ont été menés pour identifier les complexes CKD9-CIP-BCL6 les plus performants. Le composé a été testé sur 859 types de cellules cancéreuses, montrant une élimination efficace des cellules malignes. Les complexes les plus efficaces ont montré une efficacité 100 fois supérieure à celle des composés ciblant uniquement CDK9 ou BCL6, à des concentrations sous-nanomolaires.
Les essais sur des souris saines n’ont révélé aucun effet secondaire majeur. Cependant, le composé a également affecté des lymphocytes B sains, ces cellules immunitaires étant également régulées par BCL6. Le composé s’est avéré 200 fois moins toxique pour les lymphocytes B sains que pour les cellules cancéreuses.
Étant donné que BCL6 régule 13 gènes impliqués dans l’apoptose, les experts estiment que cette thérapie pourrait être efficace pour les cancers résistants aux traitements. Les cellules tumorales développent rapidement une tolérance aux thérapies ciblant un seul facteur oncogène. Certaines stoppent la croissance tumorale sans éliminer complètement les cellules cancéreuses. L’équipe pense qu’en ciblant plusieurs voies apoptotiques, la tumeur ne survivrait pas assez longtemps pour développer une résistance, bien que cette hypothèse doive encore être vérifiée.
La prochaine étape consiste à tester le composé sur des modèles murins de lymphome diffus à grandes cellules B, afin de collecter des données précliniques en vue de futurs essais cliniques. Les chercheurs prévoient également d’explorer d’autres molécules similaires ciblant d’autres protéines oncogènes, telles que la Ras, impliquée dans plusieurs formes de cancer.