La mise en évidence croissante de symptômes entériques liés à la maladie de Parkinson a amené à soupçonner son origine intestinale. Une expérience in vivo suggère que la pathologie est déclenchée suite à une réaction auto-immune au niveau des intestins — des années avant l’apparition des premiers troubles du mouvement. Ces résultats renforcent les perspectives de diagnostic précoce pour potentiellement freiner la maladie dans son élan.
En vue des symptômes moteurs flagrants — résultant de la perte de neurones dopaminergiques —, les scientifiques ont longtemps supposé que la maladie de Parkinson se déclenchait en premier lieu au niveau du cerveau. Cependant, sa pathogenèse débute bien avant le diagnostic et la perte neuronale ne se manifesterait qu’au stade avancé de la pathologie. En revanche, on observe fréquemment des symptômes entériques à son stade précoce. La constipation est par exemple un symptôme rapporté chez 70% des patients jusqu’à 20 ans avant l’apparition des premiers symptômes moteurs.
Malgré les preuves croissantes de l’implication du système nerveux entérique dans une large gamme de maladies neurodégénératives, les mécanismes sous-jacents à cette corrélation restent incompris. En effet, il y a une importante hétérogénéité dans les hypothèses suggérées. Si certaines évoquent une origine microbiotique, d’autres penchent plutôt pour une origine auto-immune. La nouvelle étude, dirigée par des chercheurs de l’Université de Columbia, appuie cette dernière hypothèse, en mettant en évidence des réactions auto-immunes entériques chez des modèles murins de la maladie.
Une maladie partiellement auto-immune
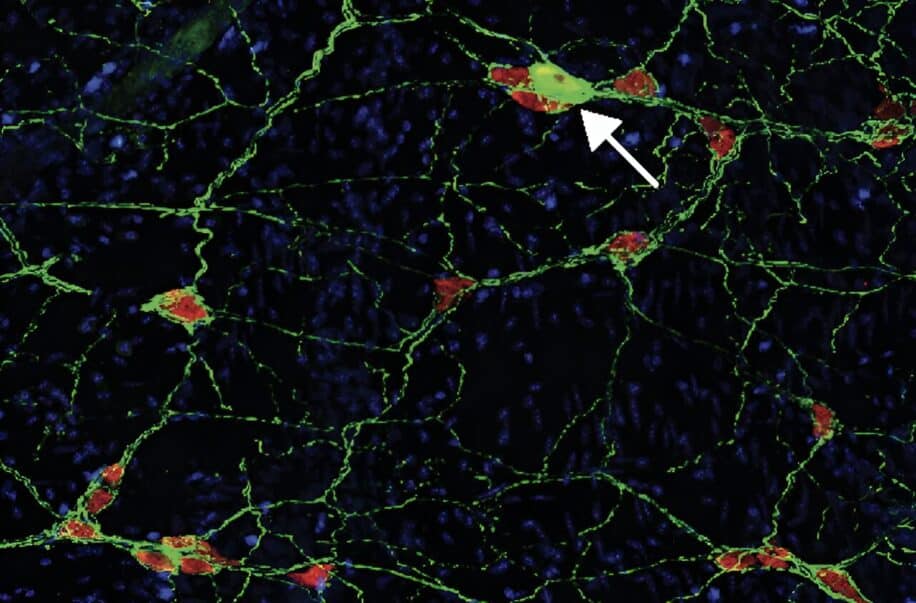
L’une des principales caractéristiques de la maladie de Parkinson est l’agrégation de la protéine alpha-synucléine à l’intérieur des neurones, qui, en se repliant de façon anormale, devient toxique et entraîne leur mort. Les experts de la nouvelle étude, détaillée dans la revue spécialisée Neuron, ont découvert que la protéine mal repliée pouvait également envahir le milieu extracellulaire. Cette présence à l’extérieur des neurones est susceptible de déclencher une réponse immunitaire et de provoquer des dommages inflammatoires plus importants que l’accumulation interne de la protéine.
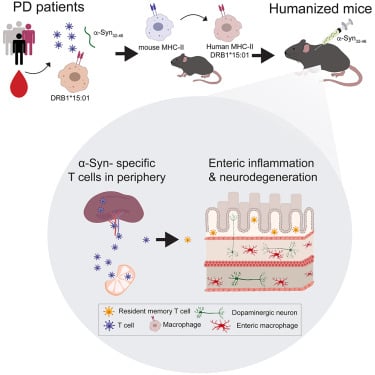
À savoir que le sang des personnes souffrant de Parkinson présente un taux élevé de cellules immunitaires spécifiques au système nerveux, « mais on ne sait pas où ni quand elles sont amorcées », indique dans un communiqué l’auteur principal de l’étude, David Sulzer de l’Université de Columbia. Avec son équipe, il estime que cette réaction débute en premier lieu dans l’intestin. Cette hypothèse est compatible avec de précédentes recherches épidémiologiques, indiquant une étroite corrélation entre l’inflammation intestinale et les stades précoces de la maladie. Il est suggéré que cette réaction de pathogénicité se propage ensuite au cerveau, en remontant via le nerf vague.
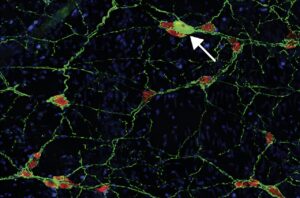
Afin de tester leur hypothèse, les chercheurs de Columbia ont génétiquement modifié des souris pour qu’elles présentent des agrégations anormales d’alpha-synucléine à l’extérieur de leurs neurones, au niveau cérébral et intestinal. Il a été constaté que la présence des protéines toxiques dans l’intestin déclenchait une réponse auto-immune, induisant l’inflammation à l’origine des symptômes gastro-intestinaux couramment observés chez la plupart des patients au stade précoce (tels que la constipation). « Cela montre qu’une réaction auto-immune peut conduire à ce qui semble être les premiers stades de la maladie de Parkinson et confirme que la maladie de Parkinson est en partie auto-immune », estime Sulzer.
Ces résultats confirment que l’inflammation du système nerveux périphérique (reliant le cerveau et la moelle épinière à l’intestin et aux autres organes internes) est très probablement impliquée dans la pathogénicité de Parkinson. D’autre part, des taux élevés de cytokines proinflammatoires et de lymphocytes T circulants exprimant la CD4+ ont été détectés chez les patients au stade précoce. Ces lymphocytes reconnaissent spécifiquement les néo-épitopes dérivés de l’alpha-synucléine. Les néoépitopes sont reconnus par le système immunitaire comme des cibles pour les lymphocytes T et peuvent déclencher une réponse. Plus particulièrement, l’α-syn 32-46, l’un de ces néoépitopes, se lie avec une forte affinité au gène HLA-DRB1∗15:01, impliqué dans les maladies auto-immunes.
L’injection de α-syn 32-46 chez les souris exprimant le HLA-DRB1∗15:01 humain déclenche une inflammation intestinale et provoque une perte de neurones entériques dopaminergiques, une constipation et une perte de poids — d’après les chercheurs de l’étude. L’injection a également activé des signatures génétiques de l’immunité innée et adaptative au niveau de l’intestin et a induit des changements des cellules T-CD4+.
En revanche, aucune réponse notable n’a été détectée au niveau du cerveau lors de l’expérience chez les souris. L’équipe de recherche estime que du fait de leur jeune âge, leur barrière hématoencéphalique n’est pas encore suffisamment affaiblie pour laisser passer les cellules immunitaires. Il s’agit probablement de la raison pour laquelle la maladie progresse avec le vieillissement et que les patients d’âge avancé développent à la fois des symptômes gastro-intestinaux et neurologiques. Toutefois, plus de recherches sont nécessaires pour véritablement confirmer cette hypothèse.