Au début de la pandémie, les inquiétudes du corps médical se sont rapidement portées sur les complications observées au niveau du système pulmonaire. Chez les cas les plus graves, des difficultés respiratoires apparaissent très vite, nécessitant une intubation. Mais plus les semaines passent, plus l’effet délétère du SARS-CoV-2 se précise. Et les complications s’avèrent en réalité bien plus étendues. Des scientifiques de l’Hôpital universitaire de Zürich viennent de mettre en évidence l’impact cardiovasculaire du virus.
Les premiers cas graves présentaient essentiellement des complications au niveau de l’appareil respiratoire, du type pneumonie. Mais peu à peu, les médecins ont constaté de plus en plus de complications au niveau cardiovasculaire, entraînant des défaillances multiples d’organes, sans aucun lien avec la pneumonie.
Le SARS-CoV-2 infecte son hôte via le récepteur de l’enzyme de conversion 2 de l’angiotensine (noté ACE2) ; cette enzyme se trouve à la surface des cellules de plusieurs organes, dont les poumons, le cœur, les reins et l’intestin. Les récepteurs ACE2 sont également exprimés par les cellules endothéliales, qui se situent sur la couche interne des vaisseaux sanguins – et qui sont donc en contact direct avec le sang et concernent tous les organes. Or, des expériences in vitro ont montré que le SARS-CoV-2 peut infecter directement les vaisseaux sanguins humains. Face à ce constat, une équipe de l’Hôpital universitaire de Zürich a soupçonné et démontré l’implication des cellules endothéliales dans l’évolution de la maladie. Leurs résultats viennent d’être publiés dans la revue The Lancet.
Des traces de morts cellulaires et de dégradation des vaisseaux
Le groupe de chercheurs zurichois, mené par Zsuzsanna Varga, a donc examiné des échantillons de tissus de patients décédés pour vérifier leur hypothèse. Le premier cas étudié était un patient de 71 ans, ayant subi une transplantation rénale, atteint d’une maladie coronarienne et d’hypertension artérielle. Même sous respiration artificielle, son état s’est rapidement détérioré conduisant à la défaillance de plusieurs organes ; le patient est décédé au 8e jour. L’analyse post mortem du rein transplanté a mis en évidence la présence du virus dans les cellules endothéliales (voir fig. A et B ci-dessous).
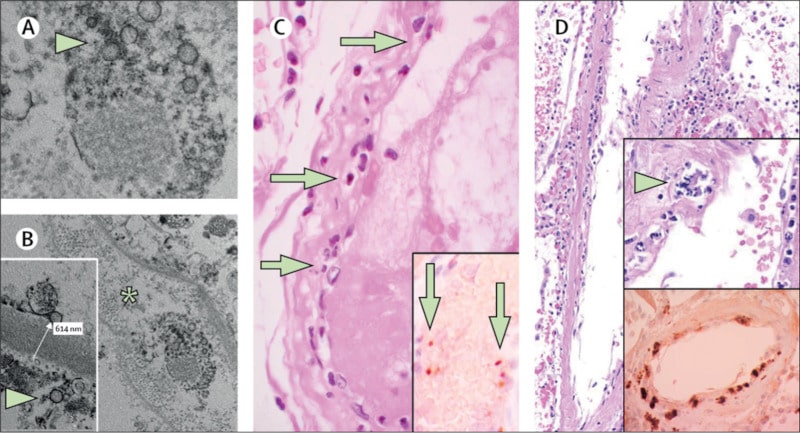
Les analyses histologiques ont révélé en outre une inflammation importante des cellules endothéliales, ainsi que des corps apoptotiques (des fragments de cellules, caractéristiques de la mort cellulaire), dans le cœur, l’intestin grêle (fig. C) et le poumon (fig. D). Une accumulation de cellules mononucléaires a été observée dans les poumons et la plupart des petits vaisseaux pulmonaires semblaient congestionnés.
Le deuxième cas d’étude était une femme de 58 ans, atteinte de diabète, d’hypertension artérielle et d’obésité. Elle aussi a rapidement développé une insuffisance respiratoire, puis une défaillance organique. Après l’ablation d’une partie de l’intestin grêle, une insuffisance circulatoire s’est produite au niveau du ventricule droit, conduisant à un infarctus du myocarde, puis à la mort. Là encore, l’histologie post mortem a révélé une inflammation des cellules endothéliales dans les poumons, le cœur, les reins et le foie, ainsi qu’une nécrose des cellules hépatiques. L’histologie de l’intestin grêle a également montré une endothélite des vaisseaux sous-muqueux.
Enfin, le troisième cas était un homme de 69 ans, souffrant d’hypertension. Il a très vite été placé sous respiration artificielle. L’échocardiographie a montré une réduction de la fraction d’éjection – le pourcentage d’éjection du sang contenu dans une cavité cardiaque lors d’un battement – au niveau du ventricule gauche. Une défaillance circulatoire a suivi, avec une ischémie mésentérique (les artères irriguant l’intestin étaient atteintes) ; une résection de l’intestin grêle a été réalisée et le patient a survécu. L’histologie des tissus prélevés a révélé une inflammation proéminente de l’endothélium des vaisseaux sous-muqueux, ainsi que des corps apoptotiques.
Une inflammation vasculaire systémique
Conclusion : le virus attaque le système immunitaire non pas uniquement par les poumons – comme on le pensait jusqu’alors – mais aussi via les récepteurs ACE2 des cellules endothéliales, qui traversent plusieurs organes. L’endothélium se dégrade peu à peu et ne parvient plus à assurer ses fonctions, alors qu’il est essentiel au maintien de l’homéostasie vasculaire ; il doit contenir le sang dans les vaisseaux, permettre l’échange des substances nutritives entre le sang et le reste de l’organisme, inhiber la coagulation sanguine et contrôler la vasomotricité (la modulation du diamètre des vaisseaux en fonction des modifications de l’environnement).
D’où les défaillances multiples d’organes observées chez certains patients : la dysfonction endothéliale entraîne davantage de vasoconstriction (le diamètre des vaisseaux diminue), entraînant une ischémie d’organes (les organes ne sont plus suffisamment irrigués) et une inflammation des tissus associés. « La maladie COVID-19 peut toucher les vaisseaux sanguins de tous les organes », résume Frank Ruschitzka, directeur de la clinique de cardiologie de l’Hôpital universitaire de Zürich, qui suggère désormais de baptiser ce tableau clinique « COVID-endothélite ».
Les résultats de Varga et son équipe confirment que les thérapies visant à stabiliser le système vasculaire, tout en s’attaquant à la réplication virale, s’avèrent tout à fait opportunes. L’équipe précise que ce type de traitement serait particulièrement pertinent pour soigner les patients vulnérables présentant un dysfonctionnement endothélial préexistant ; un état généralement associé au sexe masculin, au tabagisme, à l’hypertension, au diabète, à l’obésité et aux maladies cardiovasculaires.
Sur le même sujet : COVID-19 : la sévérité de l’infection pourrait dépendre de votre génome
Cette étude explique par ailleurs pourquoi les patients plus jeunes et en bonne santé développent moins de complications : leur endothélium est généralement en meilleure « forme » que celui des personnes âgées ou des malades chroniques souffrant d’hypertension, de diabète ou de maladies cardiovasculaires. Ils sont donc plus aptes à se défendre contre le virus.
S’il est désormais avéré que la maladie peut endommager le cœur ou provoquer des embolies pulmonaires, voire obstruer des vaisseaux sanguins dans le cerveau ou le système gastro-intestinal, d’autres effets secondaires commencent à émerger des services de réanimation. Plusieurs dysfonctionnements du système nerveux central ont été signalés : anosmie ou agueusie (perte de l’odorat et du goût), AVC, troubles de la conscience et désorientation, encéphalite (inflammation cérébrale), myélite (inflammation de la moelle épinière), syndrome de Guillain-Barré (atteinte des nerfs périphériques et paralysie).
De futures études doivent déterminer si le SARS-CoV-2 est réellement neuro-invasif. En d’autres termes, les scientifiques cherchent à savoir si ces symptômes neurologiques sont des manifestations de la maladie elle-même, ou s’ils sont eux aussi liés à une réponse inflammatoire systémique.