L’évolution rapide du SARS-CoV-2 à travers ses variants (tels qu’Omicron) hautement transmissibles et présentant une grande « résistance » aux vaccins actuels, souligne la nécessité de développer des anticorps thérapeutiques avec de larges activités neutralisantes. Les flambées successives de cette maladie et les symptômes à long terme en font un enjeu majeur de santé publique. Récemment, des scientifiques ont identifié un anticorps particulier pouvant neutraliser toutes les formes et tous les sous-variants du SARS-CoV-2 et du SARS-CoV-1. Cet anticorps soulève un espoir important face à l’inégalité d’accès aux vaccins dans certaines régions du monde et de contrôle de la propagation du virus.
En réponse à la pandémie de la COVID-19, plusieurs vaccins, anticorps thérapeutiques et médicaments antiviraux ont été développés, contribuant à réduire, ensemble, la propagation du virus. Cependant, l’émergence continue de nouveaux variants avec une transmissibilité accrue a mis en évidence la nécessité de développer des interventions thérapeutiques et préventives à large spectre, capables de neutraliser un large spectre de variantes virales.
Sans compter que les sous-variants d’Omicron BA.2, BA.2.12.1 et BA.4/BA.5, qui circulent actuellement, sont dotés d’un fort pouvoir d’échappement immunitaire, ce qui les rend moins sensibles aux vaccins anti-COVID-19 aujourd’hui disponibles et, partiellement voire totalement résistants à certains anticorps monoclonaux thérapeutiques.
Récemment, des chercheurs ont identifié et évalué cliniquement un anticorps qui neutralise largement les principales formes de coronavirus de la COVID-19 (SARS-CoV-2), qui comprend les variants Alpha, Bêta, Delta et Omicron. Il serait également efficace contre le SARS-CoV-1. Les résultats sont publiés dans la revue Science Immunology.
Un anticorps ciblant un épitope spécifique du virus
La quasi-totalité des anticorps monoclonaux neutralisants en développement ciblent la glycoprotéine de pointe du SARS-CoV-2, qui a une action médiatrice sur l’entrée virale dans les cellules hôtes. La zone visée (RBD) permet au coronavirus de s’arrimer au récepteur ACE2 présent sur les cellules cibles. Lors de l’entrée du virus dans les cellules cibles, le RBD de la protéine Spike du virus joue donc le rôle de clé, alors que le récepteur cellulaire ACE2 correspond à la serrure.
De plus, le variant Omicron ne compte pas moins de 15 mutations à ce niveau, ce qui le rend hautement résistant aux anticorps monoclonaux ainsi qu’aux anticorps induits par le vaccin. Ainsi, l’équipe du département de biologie moléculaire du Centre médical de l’Université du Texas s’est intéressée à d’autres épitopes — partie d’un antigène pouvant être reconnue par un récepteur présent à la surface de l’anticorps spécifique qui lui correspond et qui peut stimuler la production de cet anticorps — afin de trouver de nouveaux anticorps.
Concrètement, la génération d’anticorps ciblant la zone de la protéine Spike a été réalisée en inoculant la région RBD de la souche du SARS-CoV-2 d’origine (de Wuhan) à des souris. La technologie de séquençage LIBRA (Linking B cell receiver to antigen specificity via sequencing) a été utilisée pour identifier les lymphocytes B mémoire spécifiques à l’antigène, produisant des anticorps dirigés contre le virus.
L’ADN, codant pour les régions variables des récepteurs de lymphocytes B ainsi identifiés, a été inséré dans un squelette d’anticorps d’immunoglobuline humaine G1 (IgG1) pour produire des anticorps chimériques. Cela a entraîné la formation de 27 anticorps ciblant RBD et sept non ciblant RBD.
Par suite, un test de neutralisation du virus a permis de cerner sept anticorps efficaces contre la souche Wuhan du SARS-CoV-2. L’un de ces anticorps (SW186) a montré une efficacité de neutralisation optimale contre un large éventail de variants du SARS-CoV-2, notamment Alpha, Bêta, Delta, Gamma, Lambda et Mu. En effet, l’administration de SW186 à des souris après leur infection par les variants Alpha, Beta ou Delta du SARS-CoV-2 a fortement réduit la charge virale dans les poumons. De plus, le traitement par anticorps a protégé les souris contre la perte de poids, les lésions pulmonaires et l’infiltration pulmonaire de médiateurs inflammatoires.
Une configuration particulière de la liaison anticorps-antigène
L’analyse au microscope cryoélectronique du complexe anticorps-antigène a révélé que l’épitope ciblé par l’anticorps SW186 est situé à l’extérieur du motif de liaison du RBD. Cet anticorps ne se lie donc pas à l’interface RBD-ACE2.
L’épitope, quant à lui, contient un site de glycosylation (N343), important pour l’entrée virale dans les cellules hôtes, et hautement conservé parmi les coronavirus humains. Il faut savoir que la région RBD est fortement mutée dans les variants d’Omicron, ce qui entraîne leur fuite immunitaire des anticorps actuels. Cette découverte, d’un motif hautement conservé comme cible, suggère que ces mutations peuvent ne pas affecter, de manière significative, la liaison de l’anticorps SW186, qui reste de fait efficace.
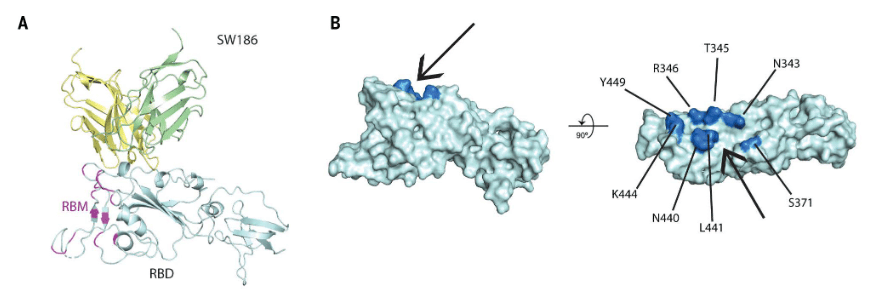


Pour tester cette hypothèse chez l’Homme, un panel d’anticorps humains a été généré, en greffant des régions déterminant la complémentarité (CDR) issues de SW186 murins. Puis ils ont été testés contre les variants Alpha, Bêta et Delta. Les résultats ont montré que la plupart de ces anticorps humains neutralisaient les variants testés avec une efficacité similaire aux anticorps murins SW186 d’origine. Enfin, les auteurs ont également identifié un autre anticorps, S309, qui se lie également à un épitope qui comprend N343.
Néanmoins, la neutralisation réduite des nouveaux sous-variants d’Omicron par SW186 et S309 indique que le virus peut encore générer de nouvelles formes qui échappent à la neutralisation des anticorps. Une ingénierie plus poussée, basée sur la structure de SW186, pourrait conduire au développement d’anticorps plus largement efficaces contre les virus du SARS en circulation, mais également futurs.