Comme l’ensemble des organes du corps, le cerveau évolue avec l’âge, subissant des transformations susceptibles d’altérer ses fonctions. Rétrécissement, perte neuronale et affaiblissement des connexions synaptiques peuvent ainsi engendrer des troubles de la mémoire, un ralentissement des processus cognitifs ou des difficultés d’apprentissage. Une récente étude met en lumière une trajectoire particulière du vieillissement cérébral, jalonnée de périodes critiques. Selon ces travaux, certaines interventions visant à freiner le déclin cognitif seraient d’autant plus efficaces lorsqu’elles sont mises en œuvre à des âges précis.
Les chercheurs s’emploient depuis longtemps à identifier des moyens de ralentir le déclin cognitif lié à l’âge, qu’il s’agisse de traitements médicamenteux, de stimulation cognitive ou encore de modifications du mode de vie, comme une alimentation adaptée et une activité physique régulière. Toutefois, le vieillissement cérébral ne suit pas une évolution linéaire, mais une courbe en S, ce qui complexifie l’identification des interventions les plus pertinentes.
Afin de mieux comprendre ce phénomène, une équipe dirigée par la neuroscientifique Lilianne Mujica-Parodi, de l’Université Stony Brook (États-Unis), et directrice du Laboratoire de neurodiagnostic computationnel (LCNeuro), a analysé la communication fonctionnelle entre différentes régions du cerveau.
Les conclusions, publiées dans la revue PNAS, révèlent qu’un premier déclin notable des capacités cérébrales survient en moyenne vers 44 ans. Cette dégradation s’accélère ensuite, atteignant un pic vers 67 ans, avant de se stabiliser aux alentours de 90 ans. « Comprendre précisément quand et comment le vieillissement cérébral s’accélère nous permet d’identifier des fenêtres temporelles stratégiques pour l’intervention », souligne la professeure Mujica-Parodi dans un communiqué.
Un stress neuronal au cœur du déclin cérébral
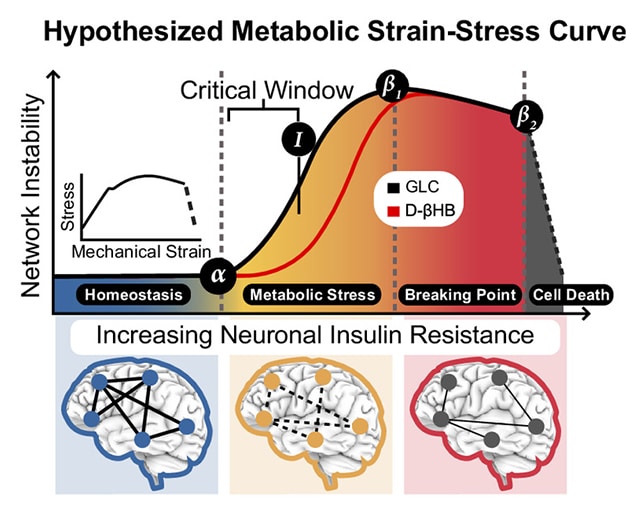
Pour parvenir à ces résultats, les scientifiques ont analysé les données de neuroimagerie de plus de 19 300 individus. Leurs travaux ont mis en évidence une période critique, située au milieu de la vie, précédant l’apparition de dommages irréversibles.
« Nous avons identifié une phase charnière, au cours de laquelle le cerveau commence à éprouver une baisse d’accès à l’énergie, mais sans que des altérations irréversibles ne soient encore installées », explique la neuroscientifique. « C’est un tournant avant la rupture », précise-t-elle.
L’étude met également en lumière un mécanisme sous-jacent, grâce à une analyse génétique approfondie : le stress neuronal associé à une résistance à l’insuline. Ce phénomène, qui peut survenir dès la quarantaine, entraîne une diminution de l’absorption du glucose par le cerveau. Deux protéines sont impliquées dans ce processus : GLUT4, qui assure le transport du glucose, et APOE, dont certaines variantes sont associées à une sensibilité accrue aux troubles métaboliques et au risque de maladie d’Alzheimer.
« À la quarantaine, les neurones subissent un stress métabolique lié à un déficit énergétique. Ils fonctionnent en mode dégradé, mais restent encore viables », précise Mujica-Parodi. Les chercheurs ont identifié un facteur protecteur potentiel : le transporteur de cétones neuronales MCT2. Cette protéine permet aux neurones d’exploiter une source d’énergie alternative, les cétones, métabolisables indépendamment de l’insuline.


Ces résultats suggèrent ainsi que restaurer ou compenser les sources d’énergie cérébrale pourrait constituer une stratégie efficace pour ralentir le vieillissement du cerveau. Afin de tester cette hypothèse, les chercheurs ont administré des suppléments de cétones à 101 participants, répartis selon différents stades du vieillissement cérébral.
L’expérience a démontré que ces suppléments amélioraient la sensibilité à l’insuline des cellules cérébrales et réduisaient les dommages métaboliques. L’effet bénéfique s’est révélé particulièrement marqué chez les individus âgés de 40 à 59 ans, période stratégique pour une intervention préventive.
« Cette découverte apporte un nouvel éclairage sur la prévention du vieillissement cérébral », souligne Botond Antal, chercheur postdoctoral en génie biomédical à Stony Brook. Plutôt que d’attendre l’apparition des premiers signes du déclin cognitif, il pourrait être pertinent d’adopter des stratégies métaboliques préventives dès la quarantaine. Parmi les pistes explorées, l’alimentation cétogène et certains suppléments nutritionnels pourraient contribuer à préserver les fonctions cérébrales.


