Des chercheurs révèlent que les ADN circulaires ont une prévalence plus élevée qu’on le pensait dans les cellules tumorales et jouent un rôle clé dans l’évolution de nombreux types de cancers. Les cellules filles issues de la division cellulaire hériteraient de manière répétée de séquences de ces ADN qui sont particulièrement avantageuses pour leur survie et leur prolifération, ce qui remet en question la loi de Mendel sur l’héritabilité des allèles génétiques.
Les ADN circulaires (ADNc) sont des séquences extrachromosomiques (ADNec) formant des boucles fermées et pouvant se répliquer de manière autonome. Ces ADNc contiennent des séquences oncogènes pouvant potentiellement favoriser le développement du cancer. Alors qu’on pensait initialement que seuls 2 % des tumeurs avaient des quantités significatives d’ADNc, des études ont montré qu’ils sont plus répandus et sont susceptibles de favoriser la prolifération de nombreux types de cancers.
Cette implication dans le développement du cancer serait due à leur capacité à favoriser l’hétérogénéité du nombre de copies lors de la division cellulaire, ainsi qu’une adaptabilité à la pression sélective. Les séquences oncogènes peuvent être fréquemment répliquées sur l’ADNec et échappent généralement au processus de contrôle de la division cellulaire.
Une série de trois études, codirigée par l’Université de Stanford, éclaire l’impact de la prévalence des ADNc dans les formes de cancer, la manière dont ils sont hérités au cours de la division cellulaire et leur impact sur l’évolution de la maladie. « Nous sommes en train de comprendre de manière totalement nouvelle un mécanisme commun et agressif qui provoque le cancer », explique dans un article de blog du Stanford Medicine, Paul Mischel, titulaire de la chaire Fortinet Founders à l’Université de Stanford et coauteur des études — publiées simultanément dans la revue Nature.
Des séquences présentes dans 17 % des tumeurs
La première étude a analysé la prévalence de l’ADNc dans 39 types de cancers différents chez près de 15 000 patients, à l’aide d’une combinaison de techniques d’imagerie, de séquençage de cellules individuelles et de modélisation informatique. Les chercheurs ont constaté que 17,1 % des tumeurs contenaient des quantités significatives d’ADNc, qui étaient associées à un risque de métastase plus élevé et un taux de survie globale plus faible. Les ADNec étaient également plus répandus chez les patients effectuant des thérapies ciblées ou des cytotoxiques (comme la chimiothérapie), suggérant la présence d’une pression sélective.
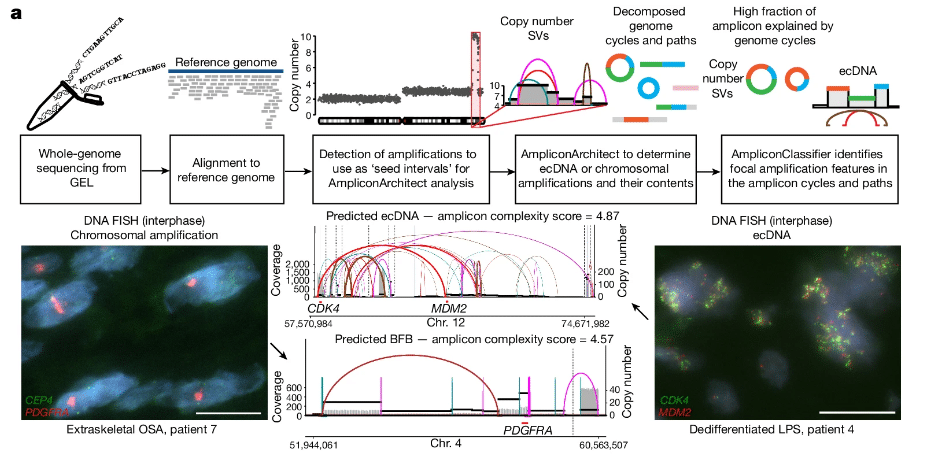
Les chercheurs ont constaté que ces ADNc pouvaient contenir à la fois des séquences oncogènes et des gènes codant pour des protéines désactivant la réponse immunitaire contre les cellules cancéreuses. Certains peuvent également contenir des séquences dites « activatrices », qui guident l’expression des gènes au niveau d’autres ADN circulaires en les reliant par paires ou plus. L’activité synergique entre ces ADN circulaires fournit un important avantage aux cellules tumorales en matière de survie et permettrait de stimuler leur croissance.
« C’était une idée quelque peu hérétique », indique le coauteur des études, Howard Chang, de l’Université de Stanford. « Si l’on regarde les choses sous un angle conventionnel, la présence d’ADNec qui code uniquement des activateurs ne semble pas poser de problème. Mais le travail d’équipe et la connexion physique entre différents types de cercles sont en fait très importants dans le développement du cancer », explique-t-il.
Une violation de la loi de Mendel
La seconde étude explore la manière dont les ADNc sont distribués à travers les cellules filles lors de la division cellulaire. Selon l’hypothèse conventionnelle sur la génétique, ces séquences devraient être distribuées de manière aléatoire. Certaines des nouvelles cellules pourraient ainsi contenir de grandes quantités d’ADNc, tandis que d’autres peu ou pas du tout. Cela signifierait qu’au moins une partie de la nouvelle population cellulaire devrait présenter la bonne combinaison d’ADNc pour désactiver les réponses immunitaires ou développer une résistance aux médicaments (pression sélective).
Cependant, Chang et ses collègues ont montré que cette règle s’applique seulement jusqu’à un certain point. En effet, contrairement aux chromosomes, la transcription des ADNc se poursuit même pendant la division cellulaire. En conséquence, les séquences restent interconnectées au cours du processus mitotique et forment ensuite des unités « multicercles » à l’intérieur des cellules filles. Autrement dit, les séquences avantageuses pour la survie des cellules sont héritées de manière répétée et non aléatoire.
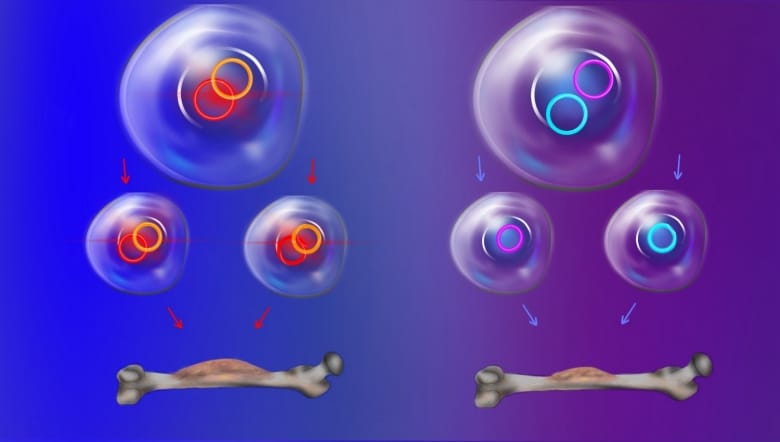


« Cela remet en cause la loi de l’indépendance des caractères de Mendel selon laquelle les gènes qui ne sont pas physiquement liés par des séquences d’ADN sont indépendants », explique Mischel. « Les cellules filles qui héritent de manière répétée des combinaisons particulièrement avantageuses de cercles d’ADNc devraient être rares si la ségrégation de chaque type de cercle est vraiment aléatoire », ajoute Chang. « Mais cette étude a montré que nous observions beaucoup plus de ces ‘événements jackpot’ que ce à quoi on pourrait s’attendre. C’est comme avoir une combinaison génétique favorable au poker. Les cellules cancéreuses qui reçoivent cette combinaison génétique favorable à plusieurs reprises ont un énorme avantage ».
Un traitement potentiel en cours d’essai clinique
La troisième étude visait à identifier les failles dans l’activité synergique des ADNc. Les chercheurs ont constaté que cette faille se situait au niveau des processus de transcription et de réplication, qui sont tous deux régulés par un système de contrôle se déplaçant le long des séquences d’ADN. Lorsque les deux systèmes entrent en collision, la division cellulaire est interrompue jusqu’à ce qu’un centre de contrôle interne résolve le « conflit ».
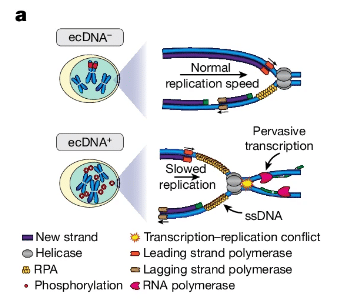


Les équipes ont identifié une protéine clé appelée CHK1, associée à ce point de contrôle. Les essais menés sur des cellules tumorales contenant de grandes quantités d’ADNc, ont montré que sa désactivation entraîne la mort des cellules. Cela a également entraîné une régression tumorale chez des modèles souris de cancer gastrique avec des ADNc. Le médicament inhibiteur de CHK1 est actuellement en phase d’essais cliniques chez des patients souffrant de plusieurs types de cancers avec des ADNc possédant plusieurs copies de gènes oncogènes.



